名校
1 . 油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量H2S)的侵蚀,生成PbS而变黑。可用一定量的H2O2溶液擦铁修复。完成下列填空:
(1)H2O2与PbS反应生成PbSO4的和H2O,写出该反应的化学方程式___________ 。
(2)在PbSO4的悬浊液中滴加一定量的CH3COONH4溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,该弱电解质的化学式为___________ 。当PbSO4和CH3COONH4恰好完全反应时,溶液显___________ 性(选填“酸性”、“中性”或“碱性”)。
(3)H2S为二元弱酸,向Na2S溶液中加入FeSO4溶液,生成FeS沉淀,还可能生成白色沉淀,其化学式为___________ ;该物质在空气中很快变为红褐色,原因是___________ 。
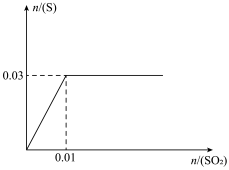
(4)向200mLH2S溶液中缓慢通入SO2,发生反应2H2S+SO2→3S +2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
+2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为___________ 。从开始通SO2至饱和,再继续通一段时间,整个过程中c(H+)的变化情况为___________ 。
(1)H2O2与PbS反应生成PbSO4的和H2O,写出该反应的化学方程式
(2)在PbSO4的悬浊液中滴加一定量的CH3COONH4溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,该弱电解质的化学式为
(3)H2S为二元弱酸,向Na2S溶液中加入FeSO4溶液,生成FeS沉淀,还可能生成白色沉淀,其化学式为
(4)向200mLH2S溶液中缓慢通入SO2,发生反应2H2S+SO2→3S
 +2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
+2H2O,生成S的物质的量与通入SO2的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中H2S的物质的量浓度为
您最近一年使用:0次
解题方法
2 . (1)在一定条件下,可以用H2O2氧化H2S。随着参加反应的 变化,氧化产物不同,当
变化,氧化产物不同,当 =4时,氧化产物的分子式为
=4时,氧化产物的分子式为________ 。
(2)利用废铁屑制备聚合硫酸铁的过程中,需要向反应釜中加入氧化剂氧化Fe2+,最合适的是________ 。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为______________ 。
(4)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_____________ 。
(5)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式___________ 。
(6)NH3在催化剂条件下还原NO2生成N2和H2O的化学方程式:_________________ 。
 变化,氧化产物不同,当
变化,氧化产物不同,当 =4时,氧化产物的分子式为
=4时,氧化产物的分子式为(2)利用废铁屑制备聚合硫酸铁的过程中,需要向反应釜中加入氧化剂氧化Fe2+,最合适的是
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO
 ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为(4)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
(5)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式
(6)NH3在催化剂条件下还原NO2生成N2和H2O的化学方程式:
您最近一年使用:0次
解题方法
3 . 资料显示: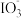 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为________ , 的还原性
的还原性________ I-(填“>”“=”或“<”)。
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入________ ,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
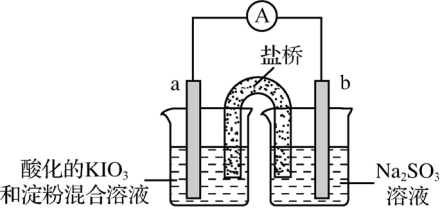
①甲同学在b电极附近的溶液中检测出了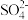
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 在a极放电的产物是
在a极放电的产物是________ 。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是________ 。
④下列说法正确的是________ 。
a. a电极附近蓝色不再褪去时, 尚未完全氧化
尚未完全氧化
b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被 还原
还原
c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
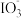 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
 的还原性
的还原性(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。

①甲同学在b电极附近的溶液中检测出了
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。
 在a极放电的产物是
在a极放电的产物是③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
④下列说法正确的是
a. a电极附近蓝色不再褪去时,
 尚未完全氧化
尚未完全氧化b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被
 还原
还原c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
您最近一年使用:0次
名校
4 . 化学还原法是处理含Cr2O 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
Cr2O
 Cr3+
Cr3+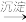 Cr(OH)3
Cr(OH)3
已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
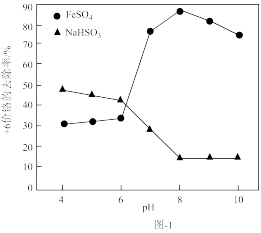
(1)取含Cr2O 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
①在酸性条件下,请写出NaHSO3与Cr2O 反应的离子方程式:
反应的离子方程式:___ 。
②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.___ 。
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。
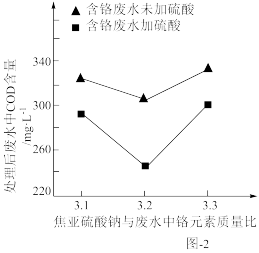
①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是___ 。
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是___ 。
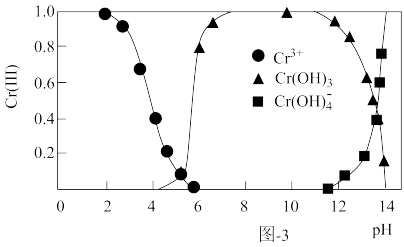
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在___ ;若pH过高,溶液中残留铬量增大,其原因为___ 。
 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:Cr2O

 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
(1)取含Cr2O
 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
①在酸性条件下,请写出NaHSO3与Cr2O
 反应的离子方程式:
反应的离子方程式:②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。

①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在

您最近一年使用:0次
2020-11-19更新
|
485次组卷
|
5卷引用:江苏省无锡市2021届高三上学期期中考试化学(选修)试题
江苏省无锡市2021届高三上学期期中考试化学(选修)试题江苏省徐州市王杰中学2021届高三12月份阶段性检测化学试题江苏省无锡市2020-2021学年高三上学期期中考试化学试题(已下线)化学-2023年高考押题预测卷01(江苏卷)(含考试版、全解全析、参考答案、答题卡)江苏省前黄高级中学2022-2023学年高三下学期二模适应性考试化学试题
名校
解题方法
5 . 硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,请分析此图并回答有关问题。
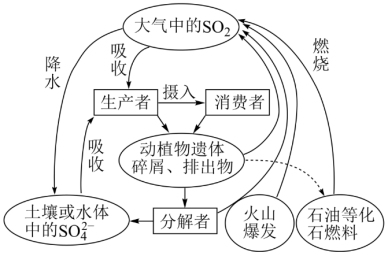
(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是________ 。
(2)分解者可将含硫有机物分解为H2S,硫磺细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢说法正确的是_______ 。
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是_________________ ,收集某次酸雨样品,发现8小时内,样品pH一直在减小,其原因可能是________________ 。(用化学方程式表示)
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______ (填化学式)。

(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是
| 选项 | 比较 | 氮循环 | 硫循环 |
| A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
| B | 氮循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
| C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
| D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是
您最近一年使用:0次



