名校
解题方法
1 . 利用下列实验研究铁与浓硫酸的反应(夹持装置已略去,气密性已检验)。
(1)实验Ⅰ中体现了浓硫酸的_______ (填“氧化性”或“还原性”)。
(2)下列装置中,能用于实验Ⅱ中尾气吸收的是_______ (填序号)。
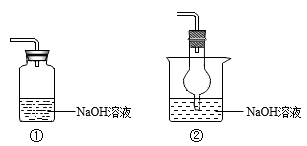
(3)实验Ⅱ中,能够证明生成了SO2的证据是_______ 。
(4)实验Ⅰ和Ⅱ中,实验现象不同的原因是_______ 。
| 实验Ⅰ | 实验Ⅱ |
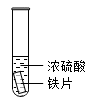 | 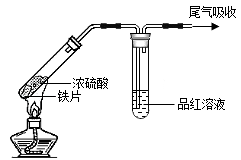 |
| 铁片表面迅速变暗,之后无明显变化 | 加热后产生大量气体,品红溶液褪色 |
(2)下列装置中,能用于实验Ⅱ中尾气吸收的是

(3)实验Ⅱ中,能够证明生成了SO2的证据是
(4)实验Ⅰ和Ⅱ中,实验现象不同的原因是
您最近一年使用:0次
2021-01-19更新
|
336次组卷
|
4卷引用:江苏省徐州市第三十五中学2020-2021学年高二10月月考化学试题
江苏省徐州市第三十五中学2020-2021学年高二10月月考化学试题北京市中国农业大学附属中学2019-2020学年高一上学期期末考试化学试题湖南省武冈市第二中学2020-2021学年高一下学期开学考试化学试题(已下线)4.1.2 硫酸的工业制备 浓硫酸的性质-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)
解题方法
2 . 铁是人体内必需的微量元素,铁的化学性质较活泼,能与很多物质发生反应。完成下列填空:
(1)常温下由于浓硫酸能使铁_______ ,因此浓硫酸可用铁槽车运输。
(2)写出铁与水蒸气反应的化学方程式_______ 。
(3)写出铁与氯气恰好完全反应的化学方程式_______ 。将产物溶于水,能得到_______ 颜色的溶液,其产物中的阳离子可以用_______ 溶液检验,写出其离子方程式_______ 。
(1)常温下由于浓硫酸能使铁
(2)写出铁与水蒸气反应的化学方程式
(3)写出铁与氯气恰好完全反应的化学方程式
您最近一年使用:0次
3 . 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用。
(1)酸性条件下,硫酸亚铁可将MnO2还原为MnSO4,该反应的离子方程式为:_____________ 。
(2)分析表明,铁在浓硫酸中发生钝化时,生成的氧化物中Fe、O两种元素的质量比为28∶11,则其化学式为______________ 。
(3)铁及其化合物可用于消除环境污染。常温下,硫酸亚铁能将SO2转化为 ,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为
,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为____________________ 。
常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2反应可生成0.5 mol N2,则y=____________ 。
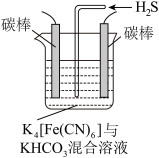
(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2 +H2S=2[Fe(CN)6]4-+2H
+H2S=2[Fe(CN)6]4-+2H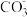 +S↓。电解时,阳极的电极反应式为
+S↓。电解时,阳极的电极反应式为___________ ;电解过程中阴极区溶液的pH______________ (填“变大”、“变小”或“不变”)。
(1)酸性条件下,硫酸亚铁可将MnO2还原为MnSO4,该反应的离子方程式为:
(2)分析表明,铁在浓硫酸中发生钝化时,生成的氧化物中Fe、O两种元素的质量比为28∶11,则其化学式为
(3)铁及其化合物可用于消除环境污染。常温下,硫酸亚铁能将SO2转化为
 ,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为
,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2反应可生成0.5 mol N2,则y=

(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2
 +H2S=2[Fe(CN)6]4-+2H
+H2S=2[Fe(CN)6]4-+2H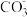 +S↓。电解时,阳极的电极反应式为
+S↓。电解时,阳极的电极反应式为
您最近一年使用:0次



