铁及其化合物在工农业生产、环境保护等领域中有着重要的作用。
(1)酸性条件下,硫酸亚铁可将MnO2还原为MnSO4,该反应的离子方程式为:_____________ 。
(2)分析表明,铁在浓硫酸中发生钝化时,生成的氧化物中Fe、O两种元素的质量比为28∶11,则其化学式为______________ 。
(3)铁及其化合物可用于消除环境污染。常温下,硫酸亚铁能将SO2转化为 ,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为
,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为____________________ 。
常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2反应可生成0.5 mol N2,则y=____________ 。
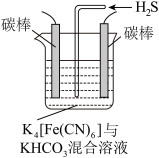
(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2 +H2S=2[Fe(CN)6]4-+2H
+H2S=2[Fe(CN)6]4-+2H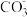 +S↓。电解时,阳极的电极反应式为
+S↓。电解时,阳极的电极反应式为___________ ;电解过程中阴极区溶液的pH______________ (填“变大”、“变小”或“不变”)。
(1)酸性条件下,硫酸亚铁可将MnO2还原为MnSO4,该反应的离子方程式为:
(2)分析表明,铁在浓硫酸中发生钝化时,生成的氧化物中Fe、O两种元素的质量比为28∶11,则其化学式为
(3)铁及其化合物可用于消除环境污染。常温下,硫酸亚铁能将SO2转化为
 ,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为
,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2反应可生成0.5 mol N2,则y=

(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2
 +H2S=2[Fe(CN)6]4-+2H
+H2S=2[Fe(CN)6]4-+2H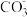 +S↓。电解时,阳极的电极反应式为
+S↓。电解时,阳极的电极反应式为
更新时间:2016-12-09 10:20:00
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】工业上,金属的制取有多种方法,选择何种方法与金属的性质密切相关。
(1)金属Na、Mg、Al等的制取常采用电解法。写出以铂为电极电解熔融氯化镁制镁的电极反应式。
阳极___________ ;阴极___________ 。
(2)金属钾因为易溶于盐而不易分离,且电解时有副反应发生,工业上通常用钠与氯化钾在高温下反应制取,该反应为:Na(l)+KCl(l) NaCl(l)+K(g);ΔH>0,根据下表有关数据回答下列问题:
NaCl(l)+K(g);ΔH>0,根据下表有关数据回答下列问题:
①制取钾的适宜温度范围为___________ 。
②制取钾的条件为___________ 。
A.适当高温高压 B.适当低温低压 C.适当高温低压 D.适当低温高压
③工业上采用此法制得的钾往往不纯,最可能含有的杂质是___________ ,检验方法为___________ 。
(3)用铝热反应方法将Fe3O4中的铁还原出来,写出该反应的化学方程式:__________ ,若用此法制得0.84t Fe,则转移电子___________ mol。
(1)金属Na、Mg、Al等的制取常采用电解法。写出以铂为电极电解熔融氯化镁制镁的电极反应式。
阳极
(2)金属钾因为易溶于盐而不易分离,且电解时有副反应发生,工业上通常用钠与氯化钾在高温下反应制取,该反应为:Na(l)+KCl(l)
 NaCl(l)+K(g);ΔH>0,根据下表有关数据回答下列问题:
NaCl(l)+K(g);ΔH>0,根据下表有关数据回答下列问题:| 物质 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) |
| Na | 0.97 | 97.81 | 890 |
| K | 0.86 | 63.65 | 770 |
| NaCl | 801 | 1465 | |
| KCl | 776 | 1437 |
①制取钾的适宜温度范围为
②制取钾的条件为
A.适当高温高压 B.适当低温低压 C.适当高温低压 D.适当低温高压
③工业上采用此法制得的钾往往不纯,最可能含有的杂质是
(3)用铝热反应方法将Fe3O4中的铁还原出来,写出该反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】自舍勒发现氯气可以作为消毒剂以来,人们陆续发现和使用了形形色色的消毒剂。
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出实验室用 和浓盐酸制氯气的化学反应方程式,并用双线桥表示电子的转移
和浓盐酸制氯气的化学反应方程式,并用双线桥表示电子的转移_________ 。反应中盐酸表现出的性质有_________ 。
(2)根据世界环保联盟的要求,二氧化氯( )消毒剂将逐渐取代
)消毒剂将逐渐取代 成为水的消毒剂。工业上常用
成为水的消毒剂。工业上常用 和
和 溶液混合并加入稀
溶液混合并加入稀 酸化后制得
酸化后制得 ,反应的离子方程式为:
,反应的离子方程式为:_________ 。
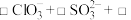 _________
_________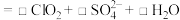
(3)高铁酸钾 是新型高效、多功能、绿色消毒剂。
是新型高效、多功能、绿色消毒剂。
①湿法制备高铁酸钾的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 ,写出湿法制备高铁酸钾的离子方程式
,写出湿法制备高铁酸钾的离子方程式_________ 。
②如下图所示,用 氧化
氧化 也可以制备高铁酸钾,反应原理为:
也可以制备高铁酸钾,反应原理为: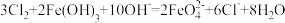 。
。

反应后取出三口瓶中的溶液于试管中,加入稀 后产生黄绿色气体
后产生黄绿色气体 ,同时检测到溶液中存在
,同时检测到溶液中存在 。制备高铁酸钾的实验中,氧化性:
。制备高铁酸钾的实验中,氧化性:
_________  (填写>,<或=)。试管中发生反应再次产生
(填写>,<或=)。试管中发生反应再次产生 的实验中,氧化性:
的实验中,氧化性:
_________  (填写>,<或=)。试说明影响
(填写>,<或=)。试说明影响 和
和 氧化性强弱的因素
氧化性强弱的因素_________ 。
(1)舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出实验室用
 和浓盐酸制氯气的化学反应方程式,并用双线桥表示电子的转移
和浓盐酸制氯气的化学反应方程式,并用双线桥表示电子的转移(2)根据世界环保联盟的要求,二氧化氯(
 )消毒剂将逐渐取代
)消毒剂将逐渐取代 成为水的消毒剂。工业上常用
成为水的消毒剂。工业上常用 和
和 溶液混合并加入稀
溶液混合并加入稀 酸化后制得
酸化后制得 ,反应的离子方程式为:
,反应的离子方程式为: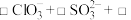 _________
_________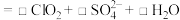
(3)高铁酸钾
 是新型高效、多功能、绿色消毒剂。
是新型高效、多功能、绿色消毒剂。①湿法制备高铁酸钾的反应体系中有六种微粒:
 、
、 、
、 、
、 、
、 、
、 ,写出湿法制备高铁酸钾的离子方程式
,写出湿法制备高铁酸钾的离子方程式②如下图所示,用
 氧化
氧化 也可以制备高铁酸钾,反应原理为:
也可以制备高铁酸钾,反应原理为: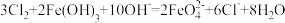 。
。
反应后取出三口瓶中的溶液于试管中,加入稀
 后产生黄绿色气体
后产生黄绿色气体 ,同时检测到溶液中存在
,同时检测到溶液中存在 。制备高铁酸钾的实验中,氧化性:
。制备高铁酸钾的实验中,氧化性:
 (填写>,<或=)。试管中发生反应再次产生
(填写>,<或=)。试管中发生反应再次产生 的实验中,氧化性:
的实验中,氧化性:
 (填写>,<或=)。试说明影响
(填写>,<或=)。试说明影响 和
和 氧化性强弱的因素
氧化性强弱的因素
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】I.现有如下物质:①液态氯化氢②氯水③ ④
④ ⑤澄清石灰水⑥铝⑦NaOH溶液⑧
⑤澄清石灰水⑥铝⑦NaOH溶液⑧ 溶液
溶液
(1)这些物质中,属于电解质的是(填编号)_______ 。
(2)将铝放入氢氧化钠溶液中有气体产生,请写出发生反应的离子方程式_______ 。
(3)把少量的④加入⑤中,离子反应方程式为_______ 。
II.已知次磷酸(H3PO2)是一元中强酸。
(4)次磷酸钡是一种溶于水的强电解质,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的离子方程式:_______ 。
(5)H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。0.1molH3PO2能还原出金属银_______ g。
 ④
④ ⑤澄清石灰水⑥铝⑦NaOH溶液⑧
⑤澄清石灰水⑥铝⑦NaOH溶液⑧ 溶液
溶液(1)这些物质中,属于电解质的是(填编号)
(2)将铝放入氢氧化钠溶液中有气体产生,请写出发生反应的离子方程式
(3)把少量的④加入⑤中,离子反应方程式为
II.已知次磷酸(H3PO2)是一元中强酸。
(4)次磷酸钡是一种溶于水的强电解质,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的离子方程式:
(5)H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。0.1molH3PO2能还原出金属银
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)自来水厂用ClO2处理后的水,可用碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入过量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。(已知:2ClO2+2I-=2ClO +I2)
+I2)
Ⅱ.Na2S2O3溶液滴定到终点。(已知:2S2O +I2=S4O
+I2=S4O +2I-)
+2I-)
问题:①滴定终点时的现象:____________
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液15 mL,则水样中ClO2的浓度是________ mol·L-1。
(2)24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是________ 。
(3)将0.64 g Cu全部溶于一定量的浓硝酸中,测得生成气体0.009 mol(含NO、NO2和N2O4),共消耗硝酸0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。计算空气中参加反应的O2在标准状况下的体积为________ mL。
Ⅰ.取一定体积的水样,加入过量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。(已知:2ClO2+2I-=2ClO
 +I2)
+I2)Ⅱ.Na2S2O3溶液滴定到终点。(已知:2S2O
 +I2=S4O
+I2=S4O +2I-)
+2I-) 问题:①滴定终点时的现象:
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液15 mL,则水样中ClO2的浓度是
(2)24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是
(3)将0.64 g Cu全部溶于一定量的浓硝酸中,测得生成气体0.009 mol(含NO、NO2和N2O4),共消耗硝酸0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。计算空气中参加反应的O2在标准状况下的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】H3PO2是一元中强酸,H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
(1)H3PO2中,P元素的化合价为_______ 。
(2)利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为_______ (填化学式)。
(3)将硫铁矿和焦炭按物质的量之比为3∶2混合放在炼硫炉中,通入适量空气中,发生下列燃烧反应:FeS2+C+O2→Fe3O4+CO+S。配平上述化学反应方程式:_______ ;生成3mol硫,被氧化物质的物质的量为_______ 。
(1)H3PO2中,P元素的化合价为
(2)利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为
(3)将硫铁矿和焦炭按物质的量之比为3∶2混合放在炼硫炉中,通入适量空气中,发生下列燃烧反应:FeS2+C+O2→Fe3O4+CO+S。配平上述化学反应方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】电解法制取Fe(OH)2,由于Fe(OH)2易被氧化,实验室很难用亚铁盐与烧碱反应得白色纯净的Fe(OH)2沉淀,用如图所示电解实验,来探究能否制得白色纯净的Fe(OH)2沉淀,两电极的材料分别为石墨和铁。
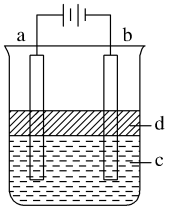
(1)a电极材料应是_______ ;b电极的电极反应式是_______ 。
(2)电解液c可以是(填编号)_______。
(3)d为苯,其作用是_______ ,在加入苯之前,对c溶液应作简单处理:_______ 。可否用其他试剂来代替苯?_______ 。
(4)为了在较短时间内看到白色沉淀,可采取的措施是_______
(5)若换为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气体,另一明显现象为_______ 。

(1)a电极材料应是
(2)电解液c可以是(填编号)_______。
| A.纯水 | B.NaOH溶液 | C.Na2SO4 | D.CuCl2溶液 |
(4)为了在较短时间内看到白色沉淀,可采取的措施是_______
| A.改用稀硫酸作电解液 | B.适当增大电源的电压 |
| C.适当减小两电极间的距离 | D.适当降低电解液的浓度 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______ 。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________ 。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________ 。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________ 。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________ 。若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为____________ 。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________ 。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】含氯消毒剂和过氧化物消毒剂均可有效灭杀新冠病毒。
Ⅰ.过碳酸钠(2Na2CO3·3H2O2)俗称固态双氧水,具有去污、杀菌等功效。其制备原理为:2Na2CO3(aq)+3H2O2(aq)=2Na2CO3·3H2O2(aq) △H<0。
(1)结合过氧化氢和碳酸钠的性质,推测制备过碳酸钠的过程中,碳酸钠与过氧化氢的物质的量之比应小于2:3,且加入Na2CO3溶液速率不能过快的原因是_______ 。
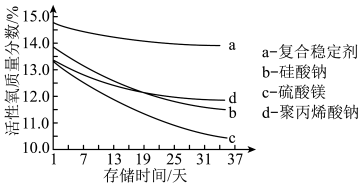
(2)过碳酸钠的储存稳定性是重要的品质指标。以不同种类的稳定剂制备的过碳酸钠产品,测得其活性氧的质量分数随时间变化如图所示。由图可知,制备过碳酸钠时应选择的稳定剂是_______ 。(填图中字母)
Ⅱ.NaClO2是一种更为安全有效的清洗﹑杀菌剂,特别是在NaClO使用受限制的场合,NaClO3是NaClO的安全代用品。
(3)工业上用石墨电极电解ClO2、NaCl溶液制备NaClO3。写出该反应的离子方程式:_______ 。
Ⅰ.过碳酸钠(2Na2CO3·3H2O2)俗称固态双氧水,具有去污、杀菌等功效。其制备原理为:2Na2CO3(aq)+3H2O2(aq)=2Na2CO3·3H2O2(aq) △H<0。
(1)结合过氧化氢和碳酸钠的性质,推测制备过碳酸钠的过程中,碳酸钠与过氧化氢的物质的量之比应小于2:3,且加入Na2CO3溶液速率不能过快的原因是
(2)过碳酸钠的储存稳定性是重要的品质指标。以不同种类的稳定剂制备的过碳酸钠产品,测得其活性氧的质量分数随时间变化如图所示。由图可知,制备过碳酸钠时应选择的稳定剂是

Ⅱ.NaClO2是一种更为安全有效的清洗﹑杀菌剂,特别是在NaClO使用受限制的场合,NaClO3是NaClO的安全代用品。
(3)工业上用石墨电极电解ClO2、NaCl溶液制备NaClO3。写出该反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】请列举铁与硝酸反应的各种情况,写出相关的离子方程式_______ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】2021年是国际化学年十周年纪念,中国的宣传口号是“化学一我们的生活,我们的未来”。
(1)高纯度单晶硅是典型的无机非金属材料,它的发现和使用曾引起计算机的一场“革命”。下列有关硅材料的说法正确的是_______(填字母)。
(2)工业上常用金属钠冶炼钛,是利用金属钠的强_______ 性。
(3)常温下,可用铁或铝制器皿盛放浓硝酸,是因为_______ 。
(4)纯碱和小苏打均为常见的厨房用品。兴趣小组同学用如图装置比较纯碱(Na2CO3)和小苏打(NaHCO3)的热稳定性。实验过程中可以观察到烧杯_______ (填“I”或“II”)中澄清石灰水变浑浊。加热后试管中发生反应的化学方程式为_______ 。

(5)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘:NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+H2O(未配平)。配平该方程式_______ 。
(1)高纯度单晶硅是典型的无机非金属材料,它的发现和使用曾引起计算机的一场“革命”。下列有关硅材料的说法正确的是_______(填字母)。
| A.晶体硅用于制作半导体材料 | B.硅在常温下化学性比较活泼 |
| C.玻璃属于硅酸盐材料 | D.玛瑙的主要成分是硅单质 |
(3)常温下,可用铁或铝制器皿盛放浓硝酸,是因为
(4)纯碱和小苏打均为常见的厨房用品。兴趣小组同学用如图装置比较纯碱(Na2CO3)和小苏打(NaHCO3)的热稳定性。实验过程中可以观察到烧杯

(5)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘:NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+H2O(未配平)。配平该方程式
您最近一年使用:0次



