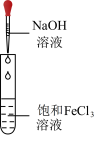
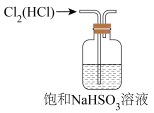
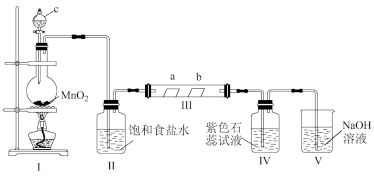
1 .  是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
 是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是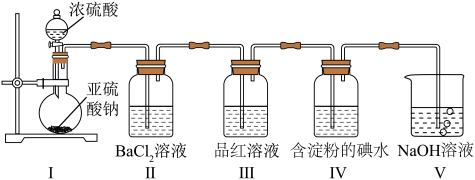
| A.装置Ⅰ中浓硫酸体现强氧化性 |
| B.装置Ⅱ无明显变化,实验结束后向其中通入空气,也无明显变化 |
C.装置Ⅲ中现象证明 具有漂白性,装置Ⅳ中现象证明 具有漂白性,装置Ⅳ中现象证明 具有氧化性 具有氧化性 |
| D.装置V中使用酸性高锰酸钾溶液也可达到实验目的 |
您最近一年使用:0次
2024-06-01更新
|
513次组卷
|
4卷引用:黑龙江省双鸭山市友谊县高级中学2024届高三下学期普通高中学业水平选择性考试模拟试题-化学试卷
黑龙江省双鸭山市友谊县高级中学2024届高三下学期普通高中学业水平选择性考试模拟试题-化学试卷 (已下线)选择题6-10(已下线)暑假作业18 化学实验综合题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)模块四非金属及其化合物(B卷)
2 . 科学探究要实事求是、严谨细致。某化学兴趣小组设计实验进行有关氯化物的探究实验,回答下列问题:
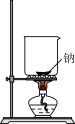
Ⅰ.FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了以Fe粉和Cl2为原料制备无水FeCl3的实验方案,装置示意图如下:___________ 。
(2)装置A中设计g管的作用是___________ 。
(3)装置A中发生反应的离子方程式为___________ 。
Ⅱ.利用惰性电极电解0.1mol/LFeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
实验数据如表所示:
(4)由实验1、2现象可以得出结论:增大pH,___________ 优先于___________ 放电;
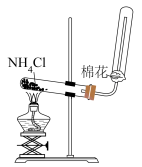
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol/L硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量X”是___________ ;
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验___________ 作对照实验;
③实验目的ii是___________ ;
④氯化铵在生产生活中有很多实用的用途,请写出一种应用:___________ 。
Ⅰ.FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了以Fe粉和Cl2为原料制备无水FeCl3的实验方案,装置示意图如下:
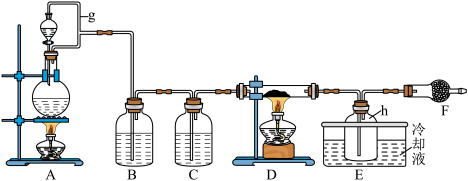
(2)装置A中设计g管的作用是
(3)装置A中发生反应的离子方程式为
Ⅱ.利用惰性电极电解0.1mol/LFeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
实验数据如表所示:
| 实验编号 | 电压/V | pH | 阳极现象 | 阴极现象 |
| 1 | 1.5 | 1.00 | 无气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
| 2 | 1.5 | 5.52 | 无气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 3 | 3.0 | 5.52 | 少量气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 4 | 4.5 | 5.52 | 大量气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
(4)由实验1、2现象可以得出结论:增大pH,
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
| 实验编号 | c(NH4Cl)/mol·L-1 | 温度/℃ | 待测物理量X | 实验目的 |
| 5 | 0.5 | 30 | a | ___________ |
| 6 | 1.5 | i | b | 探究浓度对氯化铵水解平衡的影响 |
| 7 | 1.5 | 35 | c | ii |
| 8 | 2.0 | 40 | d | 探究温度、浓度同时对氯化铵化解平衡的影响 |
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol/L硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量X”是
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验
③实验目的ii是
④氯化铵在生产生活中有很多实用的用途,请写出一种应用:
您最近一年使用:0次
3 . 校化学兴趣小组为验证Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。___________ 。
(2)装置Ⅱ的作用是___________ 。
(3)若实验中产生的Cl2足量,装置Ⅳ中的实验现象___________ 。
(4)写出装置V中反应的离子方程式___________ 。
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的___________ 装置(填序号)。
①漂白精的有效成分是___________ 。
②漂粉精常用于游泳池的消毒,起消毒作用的是HClO。漂粉精在水中释放HClO的化学方程式是:___________
③池水的酸碱性对漂粉精的消毒效果影响明显。
a.若池水碱性过强,杀毒作用会___________ (填“增强”或“减弱”)。
b.若池水酸性过强,会刺激眼睛和皮肤。有时加入Na2CO3、NaHCO3以降低酸性,起到降低酸性作用的离子分别是___________ (填离子符号)。
(2)装置Ⅱ的作用是
(3)若实验中产生的Cl2足量,装置Ⅳ中的实验现象
(4)写出装置V中反应的离子方程式
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的

①漂白精的有效成分是
②漂粉精常用于游泳池的消毒,起消毒作用的是HClO。漂粉精在水中释放HClO的化学方程式是:
③池水的酸碱性对漂粉精的消毒效果影响明显。
a.若池水碱性过强,杀毒作用会
b.若池水酸性过强,会刺激眼睛和皮肤。有时加入Na2CO3、NaHCO3以降低酸性,起到降低酸性作用的离子分别是
您最近一年使用:0次
4 .  具有氧化性、还原性和漂白性,某同学在实验室利用
具有氧化性、还原性和漂白性,某同学在实验室利用 做相关验证和探究实验。回答下列问题:
做相关验证和探究实验。回答下列问题:
(1)用如图1装置(夹持仪器已省略)验证 具有氧化性。
具有氧化性。_______ 。
②装置甲试管中反应的离子方程式为_______ 。
③说明 具有氧化性的现象为
具有氧化性的现象为_______ 。
(2)该同学设计如图2所示装置(夹持仪器已省略)制备 (难溶解于水中)。
(难溶解于水中)。_______ 。
②三颈烧瓶中反应的化学方程式为_______ 。
③该实验体现了 的性质是
的性质是_______ 。
(3)实验表明,将纯净的 缓缓地通入到
缓缓地通入到 溶液中,得到
溶液中,得到 沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
假设I:溶液中的 ;
;
假设II:溶解在水中的氧气。
①验证假设I(配制溶液前已将蒸馏水煮沸并密封冷却)。
实验ⅰ现象为_______ ,实验ⅱ的现象为_______ 。
②验证假设II.请完成下列表格:
实验iv的步骤为_______ ,实验目的是_______ 。
 具有氧化性、还原性和漂白性,某同学在实验室利用
具有氧化性、还原性和漂白性,某同学在实验室利用 做相关验证和探究实验。回答下列问题:
做相关验证和探究实验。回答下列问题:(1)用如图1装置(夹持仪器已省略)验证
 具有氧化性。
具有氧化性。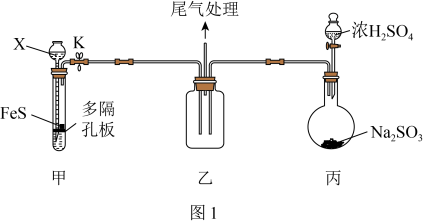
②装置甲试管中反应的离子方程式为
③说明
 具有氧化性的现象为
具有氧化性的现象为(2)该同学设计如图2所示装置(夹持仪器已省略)制备
 (难溶解于水中)。
(难溶解于水中)。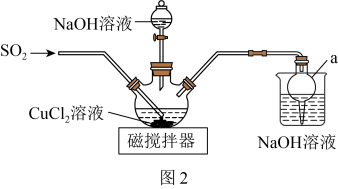
②三颈烧瓶中反应的化学方程式为
③该实验体现了
 的性质是
的性质是(3)实验表明,将纯净的
 缓缓地通入到
缓缓地通入到 溶液中,得到
溶液中,得到 沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:假设I:溶液中的
 ;
;假设II:溶解在水中的氧气。
①验证假设I(配制溶液前已将蒸馏水煮沸并密封冷却)。
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
| 实验ⅰ | 向 溶液中缓慢通入纯净的 溶液中缓慢通入纯净的 气体 气体 | 假设I成立 | |
| 实验ⅱ | 向 溶液的烧杯中缓慢通入纯净的 溶液的烧杯中缓慢通入纯净的 气体 气体 |
②验证假设II.请完成下列表格:
| 实验步骤 | 实验现象 | 实验目的 | |
| 实验ⅲ | 同实验ⅰ步骤 | 同实验ⅰ的相关现象 | 作对照实验 |
| 实验ⅳ | 产生白色沉淀 | ||
您最近一年使用:0次
5 . 为达到实验目的,下列方案设计恰当的是
| A | B | C | D | |
| 实验目的 | 制备 胶体 胶体 | 观察钠燃烧的现象 | 证明热稳定性: | 实验室收集氯气 |
| 装置 |
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-26更新
|
105次组卷
|
2卷引用:四川省成都市2023-2024学年高一上学期1月期末化学试题
6 . 某校化学兴趣小组为研究 的性质。设计如图所示装置进行实验。装置中部分夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。
的性质。设计如图所示装置进行实验。装置中部分夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。___________ 。
(2)装置Ⅱ的作用是___________ 。
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加如图所示中的___________ (填序号)装置。___________ ,氯气和Ⅴ的试剂作用可以制备漂白液,请写出反应的离子方程式:___________ 。
 的性质。设计如图所示装置进行实验。装置中部分夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。
的性质。设计如图所示装置进行实验。装置中部分夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。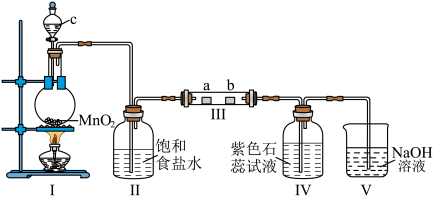
(2)装置Ⅱ的作用是
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加如图所示中的
您最近一年使用:0次
7 . 某兴趣小组在实验室制备纯净的氯气并研究氯气的性质。装置如下:____________ 。
(2)装置B的功能是:___________ ,装置C中的试剂为:___________ 。
(3)a,b均为红色布条,其中a布条为___________ 的(填“干燥”或“湿润”)。与实验目的直接相关的实验现象是___________ 。
(4)NaOH溶液的作用:____________ (用离子方程式 进行表达)。
(5)小组同学观察到D中红色褪去,并对褪色原因提出假设:
假设1:___________ 。
假设2:ClO-破坏了酚酞的结构。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许D中褪色后的溶液放入试管中,__________ (填“操作”),若___________ (填“现象”),则假设1成立。
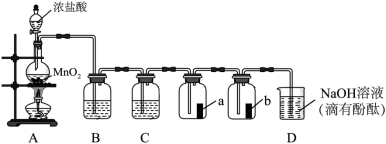
(2)装置B的功能是:
(3)a,b均为红色布条,其中a布条为
(4)NaOH溶液的作用:
(5)小组同学观察到D中红色褪去,并对褪色原因提出假设:
假设1:
假设2:ClO-破坏了酚酞的结构。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许D中褪色后的溶液放入试管中,
您最近一年使用:0次
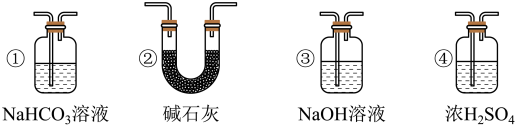
8 . 某校化学兴趣小组为验证 的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
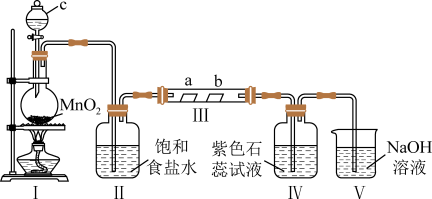
(1)装置Ⅰ中仪器c的名称是______ ,实验室用 和浓盐酸制备
和浓盐酸制备 的化学方程式为
的化学方程式为______ 。
(2)装置Ⅱ的作用是______ 。
(3)若实验中产生的 足量,装置Ⅳ中的实验现象
足量,装置Ⅳ中的实验现象______ 。
(4)写出装置Ⅴ中反应的离子方程式______ 。
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的______ 装置(填序号)。
①
 溶液 ②
溶液 ②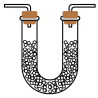 碱石灰
碱石灰
③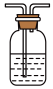
 溶液 ④
溶液 ④ 浓硫酸
浓硫酸
(6)可用 和
和 制备的漂粉精
制备的漂粉精
①漂粉精常用于游泳池的消毒,起消毒作用的是 。漂粉精在水中释放
。漂粉精在水中释放 的途径主要是:
的途径主要是:
______ (把反应补充完整)。
②池水的酸碱性对漂粉精的消毒效果影响明显。
a.若池水碱性过强,杀毒作用会______ (填“增强”或“减弱”)。
b.若池水酸性过强,会刺激眼睛和皮肤。有时加入 、
、 以降低酸性,起到降低酸性作用的离子分别是
以降低酸性,起到降低酸性作用的离子分别是______ (填离子符号)。
③漂白精中的 在碱性条件下能够制备新型净水剂——高铁酸钾
在碱性条件下能够制备新型净水剂——高铁酸钾 ,补全下面的离子方程式:
,补全下面的离子方程式:______ 。




 ______=
______=

 ______+
______+ ______
______
 的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的红色纸条,b为湿润的红色纸条。
(1)装置Ⅰ中仪器c的名称是
 和浓盐酸制备
和浓盐酸制备 的化学方程式为
的化学方程式为(2)装置Ⅱ的作用是
(3)若实验中产生的
 足量,装置Ⅳ中的实验现象
足量,装置Ⅳ中的实验现象(4)写出装置Ⅴ中反应的离子方程式
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的
①

 溶液 ②
溶液 ② 碱石灰
碱石灰③

 溶液 ④
溶液 ④ 浓硫酸
浓硫酸(6)可用
 和
和 制备的漂粉精
制备的漂粉精①漂粉精常用于游泳池的消毒,起消毒作用的是
 。漂粉精在水中释放
。漂粉精在水中释放 的途径主要是:
的途径主要是:
②池水的酸碱性对漂粉精的消毒效果影响明显。
a.若池水碱性过强,杀毒作用会
b.若池水酸性过强,会刺激眼睛和皮肤。有时加入
 、
、 以降低酸性,起到降低酸性作用的离子分别是
以降低酸性,起到降低酸性作用的离子分别是③漂白精中的
 在碱性条件下能够制备新型净水剂——高铁酸钾
在碱性条件下能够制备新型净水剂——高铁酸钾 ,补全下面的离子方程式:
,补全下面的离子方程式:



 ______=
______=

 ______+
______+ ______
______
您最近一年使用:0次
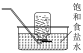
9 . 下列实验装置中能达到实验目的的是
|
|
A.装置用于除去 中少量HCl 中少量HCl | B.装置用于实验室制备 |
|
|
| C.装置可观察钠在空气中燃烧的现象 | D.操作称量NaOH固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
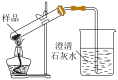
10 . 某化学兴趣小组在学校实验室进行了以下实验。回答下列问题:
(1)某有机化合物在同温同压下A蒸气对 的相对密度为30,分子中含碳的质量分数为40.0%,氢6.6%,氧53.4%。该物质既可与Na反应,又可与
的相对密度为30,分子中含碳的质量分数为40.0%,氢6.6%,氧53.4%。该物质既可与Na反应,又可与 或
或 反应,其结构简式为
反应,其结构简式为_______ 。
(2)用下图所示装置制备乙烯并验证乙烯的性质。当温度迅速上升后,可观察到试管中的溴水褪色,烧瓶中浓 与乙醇的混合液体变为棕黑色。
与乙醇的混合液体变为棕黑色。___________ 。
②甲同学认为:溴水褪色的现象不能证明装置I中有乙烯生成,原因是___________ 。
③乙同学建议:在装置I和II之间增加一个洗气装置,洗气的试剂是___________ 。
④丙同学查文献得知:若用溴水验证,反应后装置II中的产物主要为 ,含少量
,含少量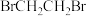 。建议将装置II中的试剂改为“溴的
。建议将装置II中的试剂改为“溴的 溶液”以排除
溶液”以排除 对乙烯与
对乙烯与 反应的干扰。写出乙烯与溴水反应生成
反应的干扰。写出乙烯与溴水反应生成 的化学方程式:
的化学方程式:___________ 。
(3)丁同学尝试分离提纯下列混合物或除去混合物中的杂质,他设计的实验方法错误的是___________ (填标号)。
(1)某有机化合物在同温同压下A蒸气对
 的相对密度为30,分子中含碳的质量分数为40.0%,氢6.6%,氧53.4%。该物质既可与Na反应,又可与
的相对密度为30,分子中含碳的质量分数为40.0%,氢6.6%,氧53.4%。该物质既可与Na反应,又可与 或
或 反应,其结构简式为
反应,其结构简式为(2)用下图所示装置制备乙烯并验证乙烯的性质。当温度迅速上升后,可观察到试管中的溴水褪色,烧瓶中浓
 与乙醇的混合液体变为棕黑色。
与乙醇的混合液体变为棕黑色。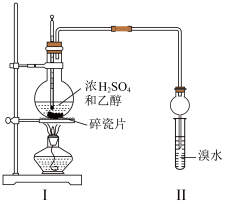
②甲同学认为:溴水褪色的现象不能证明装置I中有乙烯生成,原因是
③乙同学建议:在装置I和II之间增加一个洗气装置,洗气的试剂是
④丙同学查文献得知:若用溴水验证,反应后装置II中的产物主要为
 ,含少量
,含少量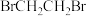 。建议将装置II中的试剂改为“溴的
。建议将装置II中的试剂改为“溴的 溶液”以排除
溶液”以排除 对乙烯与
对乙烯与 反应的干扰。写出乙烯与溴水反应生成
反应的干扰。写出乙烯与溴水反应生成 的化学方程式:
的化学方程式:(3)丁同学尝试分离提纯下列混合物或除去混合物中的杂质,他设计的实验方法错误的是
| 实验 | 实验目的 | 分离、提纯、除杂方法 |
| A | 分离苯和水 | 分液法 |
| B | 提纯含少量泥沙的粗苯甲酸 | 重结晶法 |
| C | 除去乙炔中 气体 气体 | 用 溶液洗气、干燥 溶液洗气、干燥 |
| D | 除去苯中混有的少量苯酚杂质 | 过滤 |
| E | 分离二氯甲烷、三氯甲烷、四氯化碳的混合物 | 蒸馏法 |
您最近一年使用:0次
2024-07-13更新
|
66次组卷
|
2卷引用:山西省太原市2023-2024学年高二下学期7月期末考试化学试题