1 . 化学实验是研究化学反应的有效方法。
Ⅰ.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。
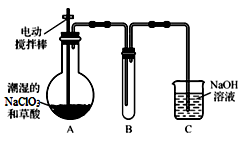
(1)实验时装置A需在60℃~100℃进行的原因是_______________ ,控制所需温度的方法是_______________ 。
(2)电动搅拌棒的作用是________________ 。装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为________________________ 。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_______________________ 。
Ⅱ.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)实验①和②的目的是_______________________ 。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________ 。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:
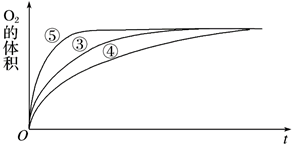
分析上图能够得出的实验结论是________________________ 。
Ⅰ.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。

(1)实验时装置A需在60℃~100℃进行的原因是
(2)电动搅拌棒的作用是
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式
Ⅱ.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:

分析上图能够得出的实验结论是
您最近一年使用:0次
2 . 小明同学在化学兴趣小组中提出一个猜想:“根据学习过的化学反应CaCO3+CO2+H2O=Ca(HCO3)2可以知道,Na2CO3溶液也能与CO2发生反应”.
为了确定小明同学猜想是否正确,兴趣小组在老师的指导下,通过实验探究的方法.完成了对该猜想的判断。请你完成兴趣小组在实验探究活动中的都分实验报告。
【实验目的】:探究Na2CO3溶液与CO2的反应
【实验药品】:Na2CO3溶液,、饱和的Na2HCO3溶液、大理石、CaCl2、CaO、稀盐酸、稀硫酸、浓硫酸、澄清石灰水
【查阅资料】:NaHCO3与Ca(OH)2发生反应:2NaHCO3 + Ca(OH)2=CaCO3↓+Na2CO3+ 2H2O碳酸氢钠与氯化钙溶液反应生成碳酸钙沉淀、氯化钠、水和二氧化碳.
【实验装置】:
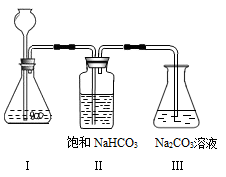
【实验操作步骤与现象】
①写出实验室制取二氧化碳的化学方程式_________________________ 。
②将制取的CO2通过饱和的NaHCO3溶液洗气瓶的目的是______________________ 。
③使过量的CO2通过装置Ⅲ,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入___________ 试剂(请从以上给出的药品中选择)当试管中出现____________ 现象时,Na2 CO3溶液与CO2发生了化学反应,其反应的化学方程式为_____________________ 。
【结论】:通过实验探究,小明同学的猜想是正确的。
【应用】:你能否依据此化学反应的规律,再写出一个类似的化学反应方程式(写上述已有的两个反应不得分):___________________________ 。
为了确定小明同学猜想是否正确,兴趣小组在老师的指导下,通过实验探究的方法.完成了对该猜想的判断。请你完成兴趣小组在实验探究活动中的都分实验报告。
【实验目的】:探究Na2CO3溶液与CO2的反应
【实验药品】:Na2CO3溶液,、饱和的Na2HCO3溶液、大理石、CaCl2、CaO、稀盐酸、稀硫酸、浓硫酸、澄清石灰水
【查阅资料】:NaHCO3与Ca(OH)2发生反应:2NaHCO3 + Ca(OH)2=CaCO3↓+Na2CO3+ 2H2O碳酸氢钠与氯化钙溶液反应生成碳酸钙沉淀、氯化钠、水和二氧化碳.
【实验装置】:

【实验操作步骤与现象】
①写出实验室制取二氧化碳的化学方程式
②将制取的CO2通过饱和的NaHCO3溶液洗气瓶的目的是
③使过量的CO2通过装置Ⅲ,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入
【结论】:通过实验探究,小明同学的猜想是正确的。
【应用】:你能否依据此化学反应的规律,再写出一个类似的化学反应方程式(写上述已有的两个反应不得分):
您最近一年使用:0次
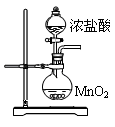
3 . 甲同学通过查询资料知道,一定浓度的硝酸与镁反应时,可得到二氧化氮、一氧化氮、氮气三种气体。该同学用下列仪器组装装置来直接验证有二氧化氮、一氧化氮生成并制取氮化镁 (假设实验中每步转化均是完全的) 。查阅文献得知:
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。
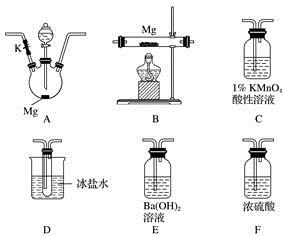
(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是________________________________ 。
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→____________ →E,确定还原产物中有二氧化氮的现象是______________________________________ ,实验中要多次使用装置F,第二次使用F的目的是______________________________________________ 。
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:________________________________ 。
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是______________________________________ 。
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:__________________________ 。
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。

(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:
您最近一年使用:0次
2016-12-09更新
|
1389次组卷
|
10卷引用:2016届湖北省沙市中学高三下第一次半月考理综化学试卷
2016届湖北省沙市中学高三下第一次半月考理综化学试卷2015-2016学年江苏省扬州中学高一下期中化学试卷(已下线)同步君 必修1 第4章 第4节 硝酸高中化学人教版 必修1 第四章 非金属及其化合物 4.氨 硫酸 硝酸 硝酸云南省元江县一中2018-2019学年高一上学期12月考试化学试题贵州省剑河县二中2018-2019学年高一上学期期末考试化学试题内蒙古集宁一中2019-2020学年高二下学期第二次月考化学试题山西省忻州市静乐县第一中学2019-2020学年高二下学期第一次月考化学试题云南省玉溪市通海二中2020-2021学年高一下学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高一下学期线上教学质量检测期中考试化学试题
4 . 小明同学在化学兴趣小组中提出一个猜想:“根据学习过的化学反应CaCO3+CO2+H2O=Ca(HCO3)2可以知道,Na2CO3溶液也能与CO2发生反应”。
为了确定小明同学猜想是否正确,兴趣小组在老师的指导下,通过实验探究的方法,完成了对该猜想的判。请你完成兴趣小组在实验探究活动中的部分实验报告。
【实验目的】:探究Na2CO3溶液与CO2的反应
【实验药品】:Na2CO3溶液、饱和的NaHCO3溶液、大理石、CaCl2、CaO、稀盐酸、稀硫酸、浓硫酸、澄清石灰水
【查阅资料】:NaHCO3与Ca(OH)2发生反应:2NaHCO3+ Ca(OH)2=CaCO3↓+Na2CO3+2H2O,碳酸氢钠与氯化钙溶液反应生成碳酸钙沉淀、氯化钠、水和二氧化碳。
【实验装置】;
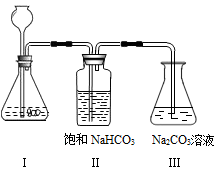
【实验操作步骤与现象】
①写出实验室制取二氧化碳的化学方程式__________________ 。
②将制取的CO2通过饱和的NaHCO3溶液洗气瓶的目的是_____________ 。
③使过量的CO2通过装置Ⅲ,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入______ 试剂(请从以上给出的药品中选择)当试管中出现_______ 现象时,Na2CO3溶液与CO2发生了化学反应,其反应的化学方程式为____________________________________ 。
【结论】:通过实验探究,小明同学的猜想是正确的。
【应用】:你能否依据此化学反应的规律,再写出一个类似的化学反应方程式(写上述已有的两个反应
不得分):________________________________ 。
为了确定小明同学猜想是否正确,兴趣小组在老师的指导下,通过实验探究的方法,完成了对该猜想的判。请你完成兴趣小组在实验探究活动中的部分实验报告。
【实验目的】:探究Na2CO3溶液与CO2的反应
【实验药品】:Na2CO3溶液、饱和的NaHCO3溶液、大理石、CaCl2、CaO、稀盐酸、稀硫酸、浓硫酸、澄清石灰水
【查阅资料】:NaHCO3与Ca(OH)2发生反应:2NaHCO3+ Ca(OH)2=CaCO3↓+Na2CO3+2H2O,碳酸氢钠与氯化钙溶液反应生成碳酸钙沉淀、氯化钠、水和二氧化碳。
【实验装置】;

【实验操作步骤与现象】
①写出实验室制取二氧化碳的化学方程式
②将制取的CO2通过饱和的NaHCO3溶液洗气瓶的目的是
③使过量的CO2通过装置Ⅲ,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入
【结论】:通过实验探究,小明同学的猜想是正确的。
【应用】:你能否依据此化学反应的规律,再写出一个类似的化学反应方程式(写上述已有的两个反应
不得分):
您最近一年使用:0次
12-13高三·四川攀枝花·阶段练习
5 . 三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。
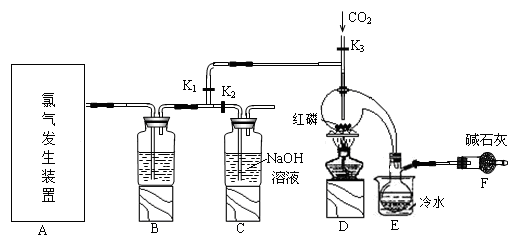
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见表。
请答下面问题:
(1)B中所装试剂是_______ ,F中碱石灰的作用是_______ 。
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是_______ ,
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过_______ (填实验操作名称),即可得到较纯净的PCl3。
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是_______ 。
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
(6)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把_______ ,然后稍稍用力即可把玻璃管插入橡皮管。甲同学将装置A的示意图画成如图所示,该示意图中明显的错误是_______ 。

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
| 实验步骤 | 实验现象 | 实验结论 |
| ① | 溶液X中含有Na+ | |
| ② | 溶液X中含有Cl- |

您最近一年使用:0次
6 . 碱式碳酸钴[Co4(OH),(CO3)4]常用作电子材料、磁性材料的添加剂,难溶于水,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置(不完整)进行试验。
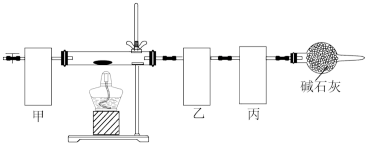
实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,…… ;
③加热硬质玻璃管,当乙装置中 ……,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(1)从下列图示选出合理的装置填于方框中,使整套实验装置完整(选填字母序号,可重复选)
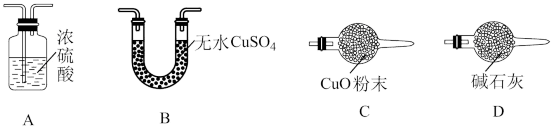
甲:乙:丙:
甲装置的作用是。
(2)步骤②中省略的实验操作为;
步骤③中乙装置的现象为;
步骤④中缓缓通入空气数分钟的目的是。
(3)若按正确装置进行实验,测得如下数据。
则该碱式碳酸钴的化学式为_____________。
(4)CO2和SO2均为酸性气体,性质相似。为了比较亚硫酸和碳酸的酸性强弱,某同学用如下装置进行实验。
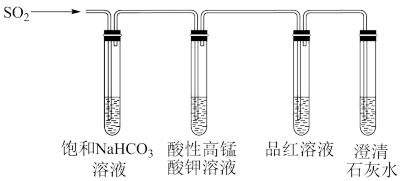
①写出该实验能达到实验目的的实验现象____________。
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸,实验方案为____________。

实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,…… ;
③加热硬质玻璃管,当乙装置中 ……,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(1)从下列图示选出合理的装置填于方框中,使整套实验装置完整(选填字母序号,可重复选)

甲:乙:丙:
甲装置的作用是。
(2)步骤②中省略的实验操作为;
步骤③中乙装置的现象为;
步骤④中缓缓通入空气数分钟的目的是。
(3)若按正确装置进行实验,测得如下数据。
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(4)CO2和SO2均为酸性气体,性质相似。为了比较亚硫酸和碳酸的酸性强弱,某同学用如下装置进行实验。

①写出该实验能达到实验目的的实验现象____________。
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸,实验方案为____________。
您最近一年使用:0次
7 . 某兴趣小组拟制备氯气并验证其一系列性质。
Ⅰ.【查阅资料】
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色。
②硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂 。
Ⅱ.【性质验证】实验装置如图所示(省略夹持装置)
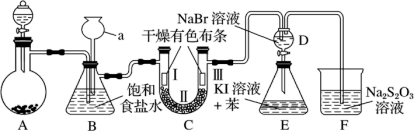
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是________ ;
装置CⅡ处加的试剂可以是____ (选填下列字母编号)。
A.碱石灰 B.硅胶 C.浓硫酸 D.无水氯化钙
(2)装置B的作用有________________________ 。
(3)写出装置F中相应的离子反应方程式:___________________________ 。
Ⅲ.【探究与反思】
上图中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的。该组的同学思考后将上述D、E、F装置改为下图所示装置进行实验。实验操作步骤如下:
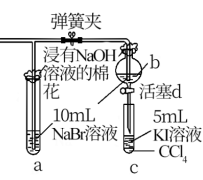
①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④ 。
(4)设计步骤③的实验目的是_________________________ 。
(5)步骤④的操作是_________________________________ 。
Ⅰ.【查阅资料】
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色。
②硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂 。
Ⅱ.【性质验证】实验装置如图所示(省略夹持装置)
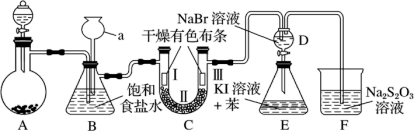
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是
装置CⅡ处加的试剂可以是
A.碱石灰 B.硅胶 C.浓硫酸 D.无水氯化钙
(2)装置B的作用有
(3)写出装置F中相应的离子反应方程式:
Ⅲ.【探究与反思】
上图中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的。该组的同学思考后将上述D、E、F装置改为下图所示装置进行实验。实验操作步骤如下:

①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④ 。
(4)设计步骤③的实验目的是
(5)步骤④的操作是
您最近一年使用:0次
2016-12-09更新
|
575次组卷
|
2卷引用:2016届湖北省孝感高级中学高三9月调考化学试卷
8 .  常用作橡胶硫化剂,是一种重要的化工原料。已知
常用作橡胶硫化剂,是一种重要的化工原料。已知 的熔点:
的熔点: ,沸点:
,沸点: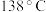 ,极易水解;实验室可通过
,极易水解;实验室可通过 与
与 在加热条件下化合生成
在加热条件下化合生成 。回答下列问题:
。回答下列问题:
(1)瑞典科学家舍勒加热 和浓盐酸的混合物首次制得了
和浓盐酸的混合物首次制得了 ,其反应的离子方程式为
,其反应的离子方程式为___________ ,实验室可用___________ 代替浓盐酸与 反应制得
反应制得 。
。
(2)制备 时,需要先制备
时,需要先制备 ,待
,待 充满装置后再加热盛有硫单质的硬质玻璃管,原因是
充满装置后再加热盛有硫单质的硬质玻璃管,原因是___________ 。
(3) 溶于水会产生浑浊现象,并放出无色有刺激性气味的气体,该反应中氧化剂与还原剂的物质的量之比为
溶于水会产生浑浊现象,并放出无色有刺激性气味的气体,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)通常采用“酸蒸馏-碘滴定法”测定 产品的纯度,装置如图所示(部分夹持及加热装置省略)。三颈烧瓶中加入一定质量的样品,锥形瓶中加少量淀粉试液和蒸馏水
产品的纯度,装置如图所示(部分夹持及加热装置省略)。三颈烧瓶中加入一定质量的样品,锥形瓶中加少量淀粉试液和蒸馏水 作为吸收液,先通入一会氮气,然后一边滴加盐酸一边持续通入氮气,锥形瓶中一边吸收一边滴加碘标准溶液滴定。
作为吸收液,先通入一会氮气,然后一边滴加盐酸一边持续通入氮气,锥形瓶中一边吸收一边滴加碘标准溶液滴定。
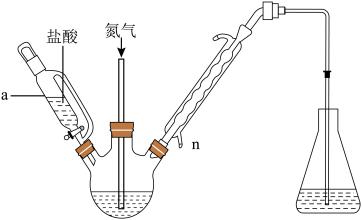
①仪器a的名称为___________ 。
②冷凝管中冷却液需从n管口进入,原因是___________ ;通入 的目的是
的目的是___________
③若四次平行实验,所加样品均为3.00g,消耗0.50mol/L碘标准溶液体积记录如下:
第一次数据不合理,可能原因是___________ (填字母)。
a.盛放0.50mol/L碘标准溶液的酸式滴定管未用标准液润洗
b.锥形瓶清洗后未干燥
c.初始时未进行赶气泡操作,有气泡残余,滴定后气泡消失
d.滴定终点读数时俯视读数
e.测定过程中氮气的流速过快
该样品的纯度为___________ (保留3位有效数字)。
 常用作橡胶硫化剂,是一种重要的化工原料。已知
常用作橡胶硫化剂,是一种重要的化工原料。已知 的熔点:
的熔点: ,沸点:
,沸点: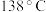 ,极易水解;实验室可通过
,极易水解;实验室可通过 与
与 在加热条件下化合生成
在加热条件下化合生成 。回答下列问题:
。回答下列问题:(1)瑞典科学家舍勒加热
 和浓盐酸的混合物首次制得了
和浓盐酸的混合物首次制得了 ,其反应的离子方程式为
,其反应的离子方程式为 反应制得
反应制得 。
。(2)制备
 时,需要先制备
时,需要先制备 ,待
,待 充满装置后再加热盛有硫单质的硬质玻璃管,原因是
充满装置后再加热盛有硫单质的硬质玻璃管,原因是(3)
 溶于水会产生浑浊现象,并放出无色有刺激性气味的气体,该反应中氧化剂与还原剂的物质的量之比为
溶于水会产生浑浊现象,并放出无色有刺激性气味的气体,该反应中氧化剂与还原剂的物质的量之比为(4)通常采用“酸蒸馏-碘滴定法”测定
 产品的纯度,装置如图所示(部分夹持及加热装置省略)。三颈烧瓶中加入一定质量的样品,锥形瓶中加少量淀粉试液和蒸馏水
产品的纯度,装置如图所示(部分夹持及加热装置省略)。三颈烧瓶中加入一定质量的样品,锥形瓶中加少量淀粉试液和蒸馏水 作为吸收液,先通入一会氮气,然后一边滴加盐酸一边持续通入氮气,锥形瓶中一边吸收一边滴加碘标准溶液滴定。
作为吸收液,先通入一会氮气,然后一边滴加盐酸一边持续通入氮气,锥形瓶中一边吸收一边滴加碘标准溶液滴定。
①仪器a的名称为
②冷凝管中冷却液需从n管口进入,原因是
 的目的是
的目的是③若四次平行实验,所加样品均为3.00g,消耗0.50mol/L碘标准溶液体积记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 初始读数(ml) | 0.21 | 0.91 | 0.83 | 0.85 |
| 终点读数(ml) | 22.56 | 20.93 | 20.81 | 20.85 |
a.盛放0.50mol/L碘标准溶液的酸式滴定管未用标准液润洗
b.锥形瓶清洗后未干燥
c.初始时未进行赶气泡操作,有气泡残余,滴定后气泡消失
d.滴定终点读数时俯视读数
e.测定过程中氮气的流速过快
该样品的纯度为
您最近一年使用:0次
名校
9 . 某实验小组利用如图装置模拟古法制硫酸并进行 性质探究。
性质探究。
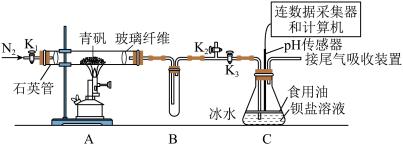
已知:①“青矾”是指 ,高温受热可完全分解得到红棕色固体和气体混合物;
,高温受热可完全分解得到红棕色固体和气体混合物;
② 熔点
熔点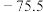 ℃,沸点
℃,沸点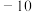 ℃:
℃: 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。
请回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 、
、 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。
(1)加热时A装置中发生反应的化学方程式为_____ 。
(2)B装置的作用是_____ 。
(3)将一定量的青矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明此固体产物不含二价铁:_____ 。
Ⅱ.探究 的性质
的性质
在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:
分别得到如下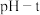 图:
图:

(4)实验①中,曲线呈缓慢下降趋势,原因是_____ 。(用方程式表示)
(5)对比分析②③数据,可得出的结论是_____ 。
Ⅲ. 含量的测定
含量的测定
(6)为对排气法收集到的 气体进行含量测定,将
气体进行含量测定,将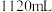 气体(已折算为标准状况)通入足量的
气体(已折算为标准状况)通入足量的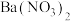 溶液中,经过滤、洗涤、烘干,最终得到沉淀
溶液中,经过滤、洗涤、烘干,最终得到沉淀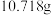 ,则
,则 体的体积分数为
体的体积分数为_____ 。若该实验数据较实际值偏大,则可能的原因是_____ 。
①气体通入速率过快②沉淀未进行恒重操作③收集的气体中有 ④未用食用油覆盖液面
④未用食用油覆盖液面
Ⅳ、 的应用
的应用
 可用于制备硫代硫酸钠晶体
可用于制备硫代硫酸钠晶体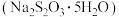 。已知
。已知 易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
实验室制备硫代硫酸钠晶体的装置如图所示。

(7)反应结束时,必须控制溶液的pH不能小于7,否则会造成的后果是_____ (用离子方程式表示)。
(8)实验结束后,进行样品纯度的测定。称取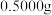 硫代硫酸钠晶体
硫代硫酸钠晶体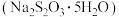 样品加水溶解,加几滴淀粉溶液,然后用
样品加水溶解,加几滴淀粉溶液,然后用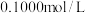 的标准碘液滴定,测得消耗标准碘液体积的平均值为
的标准碘液滴定,测得消耗标准碘液体积的平均值为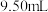 ,则该样品的纯度为
,则该样品的纯度为_____ (保留四位小数)。
已知: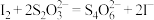 ,样品中杂质不参与反应。
,样品中杂质不参与反应。
(9)若滴定前未用标准碘液润洗滴定管,则测定样品中硫代硫酸钠晶体纯度_____ (“偏高”、“偏低”或“无影响”)。
 性质探究。
性质探究。
已知:①“青矾”是指
 ,高温受热可完全分解得到红棕色固体和气体混合物;
,高温受热可完全分解得到红棕色固体和气体混合物;②
 熔点
熔点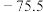 ℃,沸点
℃,沸点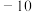 ℃:
℃: 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。请回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞
 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 、
、 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。(1)加热时A装置中发生反应的化学方程式为
(2)B装置的作用是
(3)将一定量的青矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明此固体产物不含二价铁:
Ⅱ.探究
 的性质
的性质在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入
 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:| 实验 | ① | ② | ③ |
| 所加试剂 | 已煮沸的 溶液 溶液 | 未煮沸的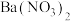 溶液 溶液 | 已煮沸的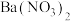 溶液 溶液 |
| 实验现象 | 无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |
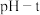 图:
图:
(4)实验①中,曲线呈缓慢下降趋势,原因是
(5)对比分析②③数据,可得出的结论是
Ⅲ.
 含量的测定
含量的测定(6)为对排气法收集到的
 气体进行含量测定,将
气体进行含量测定,将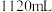 气体(已折算为标准状况)通入足量的
气体(已折算为标准状况)通入足量的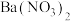 溶液中,经过滤、洗涤、烘干,最终得到沉淀
溶液中,经过滤、洗涤、烘干,最终得到沉淀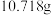 ,则
,则 体的体积分数为
体的体积分数为①气体通入速率过快②沉淀未进行恒重操作③收集的气体中有
 ④未用食用油覆盖液面
④未用食用油覆盖液面Ⅳ、
 的应用
的应用 可用于制备硫代硫酸钠晶体
可用于制备硫代硫酸钠晶体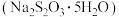 。已知
。已知 易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。实验室制备硫代硫酸钠晶体的装置如图所示。

(7)反应结束时,必须控制溶液的pH不能小于7,否则会造成的后果是
(8)实验结束后,进行样品纯度的测定。称取
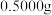 硫代硫酸钠晶体
硫代硫酸钠晶体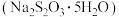 样品加水溶解,加几滴淀粉溶液,然后用
样品加水溶解,加几滴淀粉溶液,然后用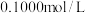 的标准碘液滴定,测得消耗标准碘液体积的平均值为
的标准碘液滴定,测得消耗标准碘液体积的平均值为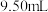 ,则该样品的纯度为
,则该样品的纯度为已知:
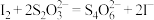 ,样品中杂质不参与反应。
,样品中杂质不参与反应。(9)若滴定前未用标准碘液润洗滴定管,则测定样品中硫代硫酸钠晶体纯度
您最近一年使用:0次
2023-07-13更新
|
713次组卷
|
3卷引用:上海市复旦大学附属中学2022-2023学年高二下学期期末等级性考试化学试题
名校
10 . 某小组同学制备碘酸盐( )并探究其性质。
)并探究其性质。
资料:① 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。
②碘酸钙 [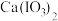 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。
③ 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。
实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热圆底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。
(1)A装置发生的化学方程式为___________ 。
(2)C装置发生的离子方程式为___________ 。
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。
①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为___________ 。
原因二:___________ (填化学式)在酸性条件下将溶液中的 氧化。
氧化。
②为了进一步证明在酸性条件下 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:
ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
ⅱ.向无色溶液X,加入与(3)等量的盐酸和 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。
ⅲ.取少量洗涤后的沉淀Y加入稀 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。
ⅳ.……
a.由实验ⅰ、ⅱ得出结论:___________ 。
b.由实验ⅲ和ⅳ得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象___________ 。
(4)根据实验ⅲ得出:氧化性
___________  (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(5)查阅资料发现,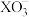 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的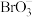 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因___________ 。
 )并探究其性质。
)并探究其性质。资料:①
 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。②碘酸钙 [
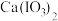 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。③
 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。实验装置如图(加热与夹持装置略)
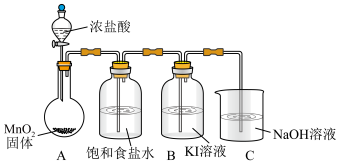
I.打开A中分液漏斗活塞,加热圆底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入
 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。(1)A装置发生的化学方程式为
(2)C装置发生的离子方程式为
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和
 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中
 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为原因二:
 氧化。
氧化。②为了进一步证明在酸性条件下
 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量
 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。ⅱ.向无色溶液X,加入与(3)等量的盐酸和
 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。ⅲ.取少量洗涤后的沉淀Y加入稀
 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。ⅳ.……
a.由实验ⅰ、ⅱ得出结论:
b.由实验ⅲ和ⅳ得出结论:在酸性条件下
 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象(4)根据实验ⅲ得出:氧化性

 (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(5)查阅资料发现,
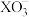 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的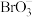 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
您最近一年使用:0次
2023-05-01更新
|
853次组卷
|
3卷引用:北京市北京师范大学附属实验中学2022-2023学年高一下学期期中考试化学试题



