名校
解题方法
1 . 吸食“冰毒”会严重破坏人的生理和免疫功能,冰毒的主要成分是甲基苯丙胺(C10H15N)。下列关于甲基苯丙胺的说法正确的是
| A.甲基苯丙胺含26个原子 | B.甲基苯丙胺中碳元素的质量分数为80% |
| C.甲基苯丙胺由碳、氢、氮三种元素组成 | D.甲基苯丙胺中各元素的质量比为10:15:1 |
您最近一年使用:0次
名校
2 . 短周期主族元素W、X、Y、Z的原子序数依次增大已知几种元素的性质或原子结构的相关叙述如表所示,回答下列问题。
(1)元素X的一种同位素可用来测定文物所属年代,这种同位素的原子符号是_______ 。
(2)Y形成的一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是_______ 。
(3)画出Z的原子结构示意图:_______ 。
(4)比较Y、Z简单离子的半径大小_______ 。
(5)由X元素组成的单质在Y元素组成的常见单质中完全燃烧,生成的产物用足量的氢氧化钠溶液吸收,反应的离子程式为_______ 。
(6)Z元素在元素周期表中的位置是:_______ ,其与Y组成的种二元化合物可以与水反应产生氧气,因此该化合物常用作供氧剂,该化合物与水反应的化学方程式为_______ ,常温常压反应产生气体32g时,转移电子数是_______ (阿伏伽德罗常数的值为NA)。
| 元素编号 | 元素性质或原子结构的相关叙述 |
| W | 单质是密度最小的气体 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 地球含量最高的元素 |
| Z | 单质与氯气化合的产物是厨房的调味剂 |
(2)Y形成的一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是
(3)画出Z的原子结构示意图:
(4)比较Y、Z简单离子的半径大小
(5)由X元素组成的单质在Y元素组成的常见单质中完全燃烧,生成的产物用足量的氢氧化钠溶液吸收,反应的离子程式为
(6)Z元素在元素周期表中的位置是:
您最近一年使用:0次
名校
3 . 用化学用语填空:空气中含量最多的气体是___________ ;地壳中含量最多的金属元素与人体中含量最多的非金属元素形成化合物的化学式为___________ 。保持水化学性质的最小粒子是___________ 。
您最近一年使用:0次
4 . 顺式Pt(NH3)2Cl2(相对分子质量为300)是临床广泛使用的抗肿瘤药物。下列有关该物质的说法中正确的是( )
| A.由4种元素组成 | B.该物质由NH3和PtCl2组成,属于混合物 |
| C.Pt的化合价为+4价 | D.铂元素的质量分数为75% |
您最近一年使用:0次
2020-11-13更新
|
103次组卷
|
2卷引用:山西省太原市十二中学2020-2021学年高一上学期10月月考化学试题
5 . 下列化学用语和描述均正确的是
A.空气中电子式为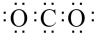 的分子含量过多会造成温室效应 的分子含量过多会造成温室效应 |
B. 原子价电子轨道表示式 原子价电子轨道表示式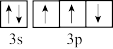 |
C.比例模型为 的分子可发生加成反应 的分子可发生加成反应 |
D.核内质子数为117,核内中子数为174的核素 可表示为: 可表示为: |
您最近一年使用:0次
6 . 可用“沉淀法”除去粗盐中的 、
、 、
、 杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
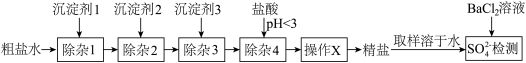
(1)实验1中加入沉淀剂3后会生成_______ (填化学式)。
(2)“除杂4”发生反应的离子方程式有_______ 。
(3)“操作X”为_______ 。
(4)查阅资料:难溶电解质的溶解度会受到溶液中其它离子的影响。加入与难溶电解质相同离子的电解质,因“同离子效应”溶解度降低;加入与难溶电解质不同离子的电解质,因“盐效应”溶解度增大。
①提出假设:
②设计实验:探究不同试剂对硫酸钡溶解度的影响程度
“滤液处理”需用到的试剂有_______ 。
③实验分析:实验3中 溶液的用量为理论值的1.5倍,最后仍检出
溶液的用量为理论值的1.5倍,最后仍检出 的原因是该体系中“同离子效应”
的原因是该体系中“同离子效应”_______ “盐效应”(填“大于”或“小于”)。
④实验结论:粗盐提纯时,为了有效降低产品中 含量,必须
含量,必须_______ 。
 、
、 、
、 杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
杂质。某小组探究沉淀剂添加顺序及过滤方式对产品中硫酸根杂质含量的影响,实验流程及结果如下。
| 沉淀剂1 | 沉淀剂1 | 沉淀剂1 | 过滤方式 |  检测结果 检测结果 | |
| 实验1 |  溶液 溶液 | NaOH溶液 |  溶液 溶液 | 逐一过滤 | 少量浑浊 |
| 实验2 |  溶液 溶液 |  溶液 溶液 | NaOH溶液 | 逐一过滤 | 少量浑浊 |
| 实验3 | NaOH溶液 |  溶液 溶液 |  溶液 溶液 | 逐一过滤 | 大量沉淀 |
| 实验4 |  溶液 溶液 | NaOH溶液 |  溶液 溶液 | 一起过滤 | 大量沉淀 |
(2)“除杂4”发生反应的离子方程式有
(3)“操作X”为
(4)查阅资料:难溶电解质的溶解度会受到溶液中其它离子的影响。加入与难溶电解质相同离子的电解质,因“同离子效应”溶解度降低;加入与难溶电解质不同离子的电解质,因“盐效应”溶解度增大。
①提出假设:
| 依据 | 假设 | |
| 假设1 | 实验1和2中 检测时出现少量浑浊 检测时出现少量浑浊 |  溶解度 溶解度 |
| 假设2 | 实验3中 检出量明显高于1和2 检出量明显高于1和2 | NaOH能明显增大 溶解度 溶解度 |
| 假设3 | NaOH或 能明显增大 能明显增大 溶解度 溶解度 |
| 探究1 | 探究2 | 探究3 | 探究4 | |
| 实验流程 | 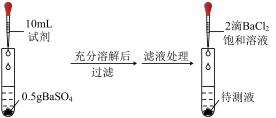 | |||
| 试剂 | 饱和食盐水 | 2 NaOH溶液 NaOH溶液 | 0.5  溶液 溶液 | 蒸馏水 |
| 现象 | 少量浑浊 | 大量沉淀 | 大量沉淀 | 无明显现象 |
③实验分析:实验3中
 溶液的用量为理论值的1.5倍,最后仍检出
溶液的用量为理论值的1.5倍,最后仍检出 的原因是该体系中“同离子效应”
的原因是该体系中“同离子效应”④实验结论:粗盐提纯时,为了有效降低产品中
 含量,必须
含量,必须
您最近一年使用:0次
2022-04-02更新
|
490次组卷
|
2卷引用:福建省八地市(福州、厦门、泉州、莆田、南平、宁德、三明、龙岩)2022届高三毕业班4月诊断性联考化学试题
解题方法
7 . 砷的化合物可用于半导体领域,如我国“天宫”空间站的核心舱“天和号”就是采用砷化镓薄膜电池来供电。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
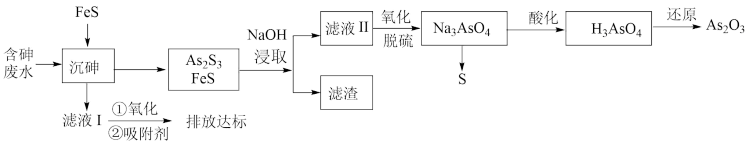
已知:
Ⅰ.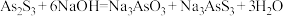
Ⅱ.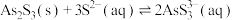
Ⅲ.砷酸( )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原
(1) 中砷元素的化合价为
中砷元素的化合价为___________ 价。
(2)“沉砷”过程中FeS是否可以用过量的 替换
替换___________ (填“是”或“否”);请从平衡移动的角度解释原因:___________ 。
(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式___________ 。
(4)用 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有___________ 。
(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。
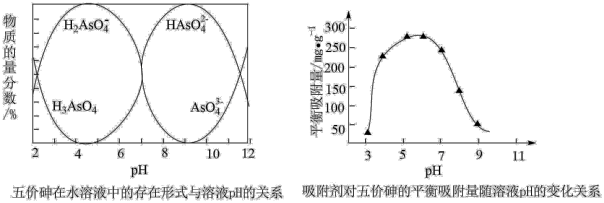
当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因_____ 。
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为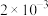 mol/L,则溶液中
mol/L,则溶液中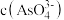 的浓度为
的浓度为_____ mol/L。该处理后的溶液是否符合国家排放标准___________ (填“是”或“否”)。(已知: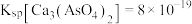 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
 )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
已知:
Ⅰ.
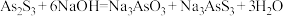
Ⅱ.
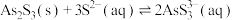
Ⅲ.砷酸(
 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原(1)
 中砷元素的化合价为
中砷元素的化合价为(2)“沉砷”过程中FeS是否可以用过量的
 替换
替换(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式
(4)用
 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。

当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为
 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为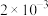 mol/L,则溶液中
mol/L,则溶液中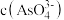 的浓度为
的浓度为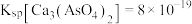 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
您最近一年使用:0次
名校
8 . 我国神舟十三号载人飞船中,宇航员要呼出 ,为使返回舱内
,为使返回舱内 浓度降低,同时保持舱内
浓度降低,同时保持舱内 含量相对稳定,要在返回舱内放入过氧化钠,其反应为:
含量相对稳定,要在返回舱内放入过氧化钠,其反应为: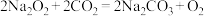 。下列有关说法正确的是
。下列有关说法正确的是
 ,为使返回舱内
,为使返回舱内 浓度降低,同时保持舱内
浓度降低,同时保持舱内 含量相对稳定,要在返回舱内放入过氧化钠,其反应为:
含量相对稳定,要在返回舱内放入过氧化钠,其反应为: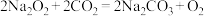 。下列有关说法正确的是
。下列有关说法正确的是| A.钠元素位于周期表中第二周期第ⅣA族 | B. 的结构示意图: 的结构示意图: |
C. 的结构式为 的结构式为 | D. 的电子式为 的电子式为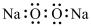 |
您最近一年使用:0次
2022-01-24更新
|
208次组卷
|
2卷引用:重庆市2021-2022学年高一上学期期末联合检测化学试题
9 . 锌钡白ZnS·BaSO4是一种常用白色颜料,以重晶石(BaSO4)和焦炭粉为原料,在回转炉中强热制取可溶性硫化钡。硫化钡在净化后形成溶液,再与硫酸锌经过一系列过程最终制得锌钡白成品。
(1)回转炉中发生反应的化学方程式为___________________________ 。
(2)回转炉尾气中含有有毒气体,生产上通入一定量的水蒸气进行处理,水蒸气的作用是_____________________________ 。
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL,滴定终点现象为__________ ,样品中S2-的含量为____________ (写出表达式与计算过程)。
(1)回转炉中发生反应的化学方程式为
(2)回转炉尾气中含有有毒气体,生产上通入一定量的水蒸气进行处理,水蒸气的作用是
(3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反应式为I2+2S2O32-=2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL,滴定终点现象为
您最近一年使用:0次
名校
10 . 根据下列叙述,对其“式”进行判断:①碱式磷酸钙的化学式为Ca4(OH)(PO4)3,②Fe3O4若看做“混合氧化物”时,可改写成FeO·Fe2O3,根据化合价规律和前述写法,则Pb3O4(四氧化三铅)可改写为2PbO·PbO2 (Pb的化合价为+2价、+4价),③为了方便某些化学计算质量分数为98%的浓H2SO4改写为9H2SO4·H2O。其中错误的是
| A.只有① | B.只有② | C.①③ | D.②③ |
您最近一年使用:0次



