名校
解题方法
1 . 乙醛是一种重要的有机化工原料,制备原理之一是2CH3CH2OH+O2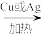 2CH3CHO+2H2O。设阿伏加德罗常数的值为NA,下列有关说法错误的是
2CH3CHO+2H2O。设阿伏加德罗常数的值为NA,下列有关说法错误的是
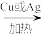 2CH3CHO+2H2O。设阿伏加德罗常数的值为NA,下列有关说法错误的是
2CH3CHO+2H2O。设阿伏加德罗常数的值为NA,下列有关说法错误的是| A.1L1mol•L-1乙醇水溶液中含有氢原子数目为6NA |
| B.44g乙醛中所含σ键的数目为6NA |
| C.18g冰中含有的氢键数目为2NA |
| D.每消耗标准状况下4.48L氧气,转移电子数为0.8NA |
您最近一年使用:0次
名校
解题方法
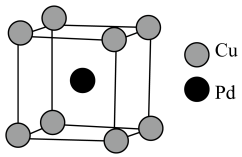
2 . 研究发现,铜钯催化剂可高效实现电催化CO还原制备乙酸,铜钯晶胞的结构如图所示。已知: 为阿伏加德罗常数的值,Cu、Pd的原子半径分别为apm、bpm。下列叙述正确的是
为阿伏加德罗常数的值,Cu、Pd的原子半径分别为apm、bpm。下列叙述正确的是
 为阿伏加德罗常数的值,Cu、Pd的原子半径分别为apm、bpm。下列叙述正确的是
为阿伏加德罗常数的值,Cu、Pd的原子半径分别为apm、bpm。下列叙述正确的是
A.该晶胞中Cu、Pd的原子个数之比为 |
| B.该晶胞的边长为4apm |
| C.该晶胞中Pd的配位数为8 |
D.标准状况下,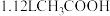 中含有的原子数目为 中含有的原子数目为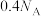 |
您最近一年使用:0次
2023-08-27更新
|
256次组卷
|
2卷引用:山西省忻州市名校2023-2024学年高三上学期开学联考化学试题
名校
3 . 阿伏加德罗常数 是一座“桥梁”,连接了宏观世界和微观世界的数量关系。通过电解法可测得
是一座“桥梁”,连接了宏观世界和微观世界的数量关系。通过电解法可测得 的数值。
的数值。
已知:i.1个电子所带电量为 库仑。
库仑。
ii.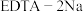 (乙二胺四乙酸二钠)能形成可溶含铜配离子。
(乙二胺四乙酸二钠)能形成可溶含铜配离子。
iii.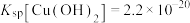 ,
, 。
。
【实验一】用铜片和铂丝为电极,电解硫酸酸化的 溶液。测得通过电路的电量为x库仑。电解完成后,取出铜片,洗净晾干,铜片质量增加了
溶液。测得通过电路的电量为x库仑。电解完成后,取出铜片,洗净晾干,铜片质量增加了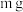 。
。
(1)铜片应连接电源的___________ (填“正极”或“负极”)。铂丝尖端产生气泡,其电极反应式为___________ 。理论上,产生气体与析出铜的物质的量之比为___________ 。
(2)本实验测得
___________  (列出计算式)。
(列出计算式)。
【实验二】为减少含重金属电解液的使用,更换电解液,同时更换电极与电源的连接方式。电解完成后,取出铜片,洗净晾干,铜片质量减小。
(3)实验①和②中各配制电解液 ,使用的主要仪器有天平、烧杯、玻璃棒、胶头滴管和
,使用的主要仪器有天平、烧杯、玻璃棒、胶头滴管和___________ 。
(4)经检验,实验①中的灰蓝色成分主要是 。从平衡移动角度解释
。从平衡移动角度解释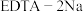 在测定
在测定 的数值中的作用:
的数值中的作用:___________ 。
(5)电解过程中,若观察到铜片上有小气泡产生,利用铜片质量减小计算 的数值
的数值___________ (填“偏大”、“偏小”或“不变”)。
(6)实验结束后处理电解液:将取出的电解液加入过量硫酸,过滤,得到白色固体 和滤液a;向滤液a中先加入
和滤液a;向滤液a中先加入 调
调 ,再加入
,再加入 ,解释不直接加入
,解释不直接加入 的原因及
的原因及 的作用:
的作用:___________ 。
 是一座“桥梁”,连接了宏观世界和微观世界的数量关系。通过电解法可测得
是一座“桥梁”,连接了宏观世界和微观世界的数量关系。通过电解法可测得 的数值。
的数值。已知:i.1个电子所带电量为
 库仑。
库仑。ii.
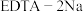 (乙二胺四乙酸二钠)能形成可溶含铜配离子。
(乙二胺四乙酸二钠)能形成可溶含铜配离子。iii.
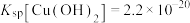 ,
, 。
。【实验一】用铜片和铂丝为电极,电解硫酸酸化的
 溶液。测得通过电路的电量为x库仑。电解完成后,取出铜片,洗净晾干,铜片质量增加了
溶液。测得通过电路的电量为x库仑。电解完成后,取出铜片,洗净晾干,铜片质量增加了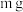 。
。(1)铜片应连接电源的
(2)本实验测得

 (列出计算式)。
(列出计算式)。【实验二】为减少含重金属电解液的使用,更换电解液,同时更换电极与电源的连接方式。电解完成后,取出铜片,洗净晾干,铜片质量减小。
| 实验 | 电解液 | 实验现象 |
| ① |  溶液 溶液 | 铜片表面为灰蓝色 |
| ② |  和 和 混合液 混合液 | 铜片表面仍为红色 |
 ,使用的主要仪器有天平、烧杯、玻璃棒、胶头滴管和
,使用的主要仪器有天平、烧杯、玻璃棒、胶头滴管和(4)经检验,实验①中的灰蓝色成分主要是
 。从平衡移动角度解释
。从平衡移动角度解释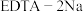 在测定
在测定 的数值中的作用:
的数值中的作用:(5)电解过程中,若观察到铜片上有小气泡产生,利用铜片质量减小计算
 的数值
的数值(6)实验结束后处理电解液:将取出的电解液加入过量硫酸,过滤,得到白色固体
 和滤液a;向滤液a中先加入
和滤液a;向滤液a中先加入 调
调 ,再加入
,再加入 ,解释不直接加入
,解释不直接加入 的原因及
的原因及 的作用:
的作用:
您最近一年使用:0次
2023-04-06更新
|
280次组卷
|
3卷引用:北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题
名校
解题方法
4 . 化学家维勒通过蒸发氰酸铵( ,盐)的水溶液得到了尿素分子
,盐)的水溶液得到了尿素分子 ,下列说法错误的是
,下列说法错误的是
 ,盐)的水溶液得到了尿素分子
,盐)的水溶液得到了尿素分子 ,下列说法错误的是
,下列说法错误的是| A.等质量的氰酸铵和尿素分子数相同 |
B. 含电子的物质的量为3.2mol 含电子的物质的量为3.2mol |
| C.组成氰酸铵的元素中位于周期表第二周期的元素有3种 |
D. 约含 约含 个氮原子 个氮原子 |
您最近一年使用:0次
2023-03-10更新
|
233次组卷
|
6卷引用:山东省济宁市2022-2023学年高一下学期开学考试(上学期期末)化学试题
名校
解题方法
5 . 下列说法正确的是
A.加入铝粉产生氢气的溶液中一定能大量共存的离子组是:Cl-、Na+、NO 、K+ 、K+ |
| B.7.8gNa2O2与CO2完全反应转移的电子数为0.2NA |
| C.足量的MnO2与0.2L12mol/L的浓盐酸在加热条件下充分反应生成Cl2的分子数目小于0.6NA |
| D.过量的铁粉在氯气中燃烧产物为氯化亚铁 |
您最近一年使用:0次
6 . NaH与水发生反应: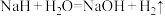 。现将0.01molNaH与适量的水完全反应,得到100mL溶液。设NA为阿伏加德罗常数的值。下列说法不正确的是
。现将0.01molNaH与适量的水完全反应,得到100mL溶液。设NA为阿伏加德罗常数的值。下列说法不正确的是
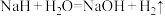 。现将0.01molNaH与适量的水完全反应,得到100mL溶液。设NA为阿伏加德罗常数的值。下列说法不正确的是
。现将0.01molNaH与适量的水完全反应,得到100mL溶液。设NA为阿伏加德罗常数的值。下列说法不正确的是| A.该反应中NaH失去电子的数目为0.02NA |
| B.0.01molNaH固体中,质子数为0.12NA |
C.所得溶液中 浓度为 浓度为 |
D.该反应中产生 的体积约为0.224L(标准状况) 的体积约为0.224L(标准状况) |
您最近一年使用:0次
2022-07-02更新
|
680次组卷
|
5卷引用:江西省瑞金市第二中学2022-2023学年高三上学期开学考试化学试题
名校
7 . 2021年,我国科学家利用 为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应:
为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应: ,设
,设 为阿伏加德罗常数,下列有关说法正确的是。
为阿伏加德罗常数,下列有关说法正确的是。
 为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应:
为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应: ,设
,设 为阿伏加德罗常数,下列有关说法正确的是。
为阿伏加德罗常数,下列有关说法正确的是。A. 中含有过氧键数目为 中含有过氧键数目为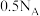 |
B.标况下, 中含有的羟基数为 中含有的羟基数为 |
| C.反应过程中HCHO为还原产物 |
D.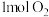 参与反应转移电子数为 参与反应转移电子数为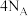 |
您最近一年使用:0次
2022-01-09更新
|
1133次组卷
|
11卷引用:黑龙江省大庆铁人中学2021-2022学年高二下学期开学考试化学试题
黑龙江省大庆铁人中学2021-2022学年高二下学期开学考试化学试题广东省汕头市2021-2022学年高三上学期期末教学质量监测化学试题(已下线)一轮巩固卷5-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)(已下线)卷02 阿伏加德罗常数的正误判断-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)查补易混易错点02 阿伏加德罗常数及应用-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)查补易混易错点02 阿伏加德罗常数及应用-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)河南省顶级名校2021-2022学年高一下学期5月月考化学试题广东省普宁市华侨中学2021-2022学年高三下学期第二次模拟考化学试题(已下线)化学(广东A卷)-学易金卷:2023年高考第一次模拟考试卷福建省泉州实验中学2022-2023学年高三上学期12月月考化学试题广东省深圳市新安中学2022-2023学年高三上学期周末测试(2022.9.25)化学试题



