真题
解题方法
1 . 硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为________ mol/L。
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收_____ g水
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2=Fe3O4+6SO2 4FeS2+11 O2=2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比_______ 。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数________ (水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2=Fe3O4+6SO2 4FeS2+11 O2=2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数
您最近一年使用:0次
2013·上海浦东新·二模
2 . 工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2+ 11 O2→ 2 Fe2O3+ 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3+ 4 SO2
(1)含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸___________ 吨(矿石中无其他含硫物质)。
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为_____ :1。
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数_____ (用含x的代数式表示)。
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl20.425mol,且溶液中无Fe3+,计算Fe1-xS中的x_____ 值(矿石中其他成分不与盐酸反应)。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2+ 11 O2→ 2 Fe2O3+ 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3+ 4 SO2
(1)含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl20.425mol,且溶液中无Fe3+,计算Fe1-xS中的x
您最近一年使用:0次
11-12高一·新疆·阶段练习
名校
3 . 在 300 mL 2 mol/L H2SO4溶液中,SO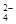 的物质的量浓度是多少?H+的物质的量浓度是多少?溶质的质量是多少?此溶液中含 H+的物质的量是少?其中含有多少个 SO
的物质的量浓度是多少?H+的物质的量浓度是多少?溶质的质量是多少?此溶液中含 H+的物质的量是少?其中含有多少个 SO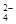 ?
?
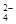 的物质的量浓度是多少?H+的物质的量浓度是多少?溶质的质量是多少?此溶液中含 H+的物质的量是少?其中含有多少个 SO
的物质的量浓度是多少?H+的物质的量浓度是多少?溶质的质量是多少?此溶液中含 H+的物质的量是少?其中含有多少个 SO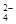 ?
?
您最近一年使用:0次
4 . 将一定质量的Mg和Al混合物投入400 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
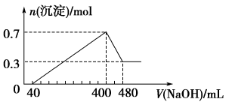
计算:
(1)Mg和Al的总质量为________ g;
(2)硫酸的物质的量浓度为________ ;
(3)生成H2的物质的量为________ 。

计算:
(1)Mg和Al的总质量为
(2)硫酸的物质的量浓度为
(3)生成H2的物质的量为
您最近一年使用:0次
2011-01-14更新
|
1015次组卷
|
3卷引用:2018年高一化学(人教版)必修1综合题型练习卷:几种重要的金属化合物
2018年高一化学(人教版)必修1综合题型练习卷:几种重要的金属化合物(已下线)2010年黑龙江“五校联谊”高一上学期期末考试化学卷江西省吉安市安福二中、吉安县三中2018-2019学年高一上学期第二次联考化学试题
10-11高一上·江西新余·期中
名校
解题方法
5 . 有一种气体的质量是14.2g,标况下的体积是4.48L,该气体的摩尔质量是多少?
您最近一年使用:0次
9-10高二下·浙江·期末
名校
6 . 氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol/L HCl标准溶液滴定至终点,共消耗标准液20.0 mL(杂质不与酸反应),试样中氢氧化钡的物质的量为________ mol。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,则Ba(OH)2·nH2O中的n的值为________ 。
(3)试样中Ba(OH)2·nH2O的质量分数为________ 。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol/L HCl标准溶液滴定至终点,共消耗标准液20.0 mL(杂质不与酸反应),试样中氢氧化钡的物质的量为
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,则Ba(OH)2·nH2O中的n的值为
(3)试样中Ba(OH)2·nH2O的质量分数为
您最近一年使用:0次



