2024·吉林长春·三模
解题方法
1 . 丁香酚氧基乙酸不仅有抗病毒、抗菌性能,而且还有抑制脂质增加的功能。纯净的丁香酚氧基乙酸 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将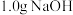 溶于
溶于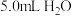 中,添加
中,添加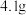 丁香酚,在
丁香酚,在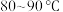 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。
II.将 氯乙酸溶解在
氯乙酸溶解在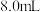 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。
III.将溶液乙缓慢滴加到溶液甲中,在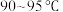 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。
回答下列问题:___________ 。
(2)若步骤I中 加入过量,产生的后果是
加入过量,产生的后果是___________ (用化学方程式表示)。
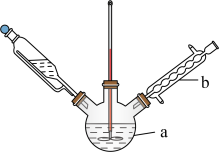
(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器 的名称是
的名称是___________ ;某同学认为不需要仪器 ,他给出的理由是
,他给出的理由是___________ 。
(4)步骤IV中碎冰的作用为___________ 。
(5)步骤V分离提纯方法的名称是___________ 。
(6)本实验的产率为___________ (保留三位有效数字)。
 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将
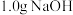 溶于
溶于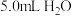 中,添加
中,添加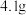 丁香酚,在
丁香酚,在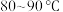 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。II.将
 氯乙酸溶解在
氯乙酸溶解在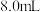 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。III.将溶液乙缓慢滴加到溶液甲中,在
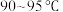 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加
 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。回答下列问题:
(2)若步骤I中
 加入过量,产生的后果是
加入过量,产生的后果是(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器
 的名称是
的名称是 ,他给出的理由是
,他给出的理由是(4)步骤IV中碎冰的作用为
(5)步骤V分离提纯方法的名称是
(6)本实验的产率为
您最近一年使用:0次
2024高三下·全国·专题练习
2 . I.“皮鞋很忙的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)计算、称量。配制该溶液需称取NaOH晶体的质量为_______ g。
(2)配制时,下列操作会导致所配溶液浓度偏高的是_______ 。
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量NaOH时用了生锈的砝码
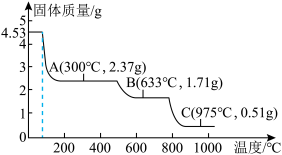
Ⅲ.取4.53gNH4Al(SO4)2∙12H2O加热分解,加热过程中固体质量随温度的变化如图所示。_______ 、_______ 。(填化学式)
A.  B.
B.  C.
C.
(1)计算、称量。配制该溶液需称取NaOH晶体的质量为
(2)配制时,下列操作会导致所配溶液浓度偏高的是
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量NaOH时用了生锈的砝码
Ⅲ.取4.53gNH4Al(SO4)2∙12H2O加热分解,加热过程中固体质量随温度的变化如图所示。
您最近一年使用:0次
2024·山西太原·一模
名校
3 . 氯化亚铜化学式为CuCl,白色立方结晶或白色粉末,难溶于水,在潮湿的空气中易氧化,不溶于乙醇,常用作催化剂、杀菌剂、媒染剂、脱色剂等。
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。___________ 。
(2)反应时使用NaCl浓溶液,主要目的是___________ 。
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为___________ ;缓慢滴加Na2SO3和Na2CO3的混合溶液的主要原因是___________ 。
(4)沉淀用无水乙醇洗涤的目的是___________ 。
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知: ,
, )
)
(5)滴定时应将Ce(SO4)2标准溶液加入___________ (填“酸式滴定管”或“碱式滴定管”)中;该样品中CuCl的质量分数为___________ ×100%。(用含a、b的代数式表示,列出计算式即可)
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
I.CuCl的制备
取25g CuSO4∙5H2O和6.43gNaCl并加少量水溶解,将溶液倒入如图所示的三颈烧瓶中,加热至50℃,向三颈烧瓶中缓慢滴加Na2SO3和Na2CO3的混合溶液,使其持续反应30min。待反应结束后将混合物静置一段时间,抽滤,沉淀依次用36%的乙酸、无水乙醇、无水乙醚洗涤多次,得白色固体,真空或者充氮气保存。

(2)反应时使用NaCl浓溶液,主要目的是
(3)三颈烧瓶中CuSO4、NaCl、Na2SO3反应生成CuCl的离子方程式为
(4)沉淀用无水乙醇洗涤的目的是
II.CuCl样品纯度的测定
准确称取CuCl样品0.25g,将其置于足量FeCl3溶液中,待固体完全溶解后,加水50mL和邻菲啰啉指示剂2滴,立即用amol∙L-1 Ce(SO4)2标准溶液滴定至绿色出现且30s不褪色,即为终点,重复2~3次,平均消耗Ce(SO4)2标准溶液bmL(已知:
 ,
, )
)(5)滴定时应将Ce(SO4)2标准溶液加入
(6)下列操作可能会导致样品纯度测量结果偏低的是___________。(填标号)
| A.样品在空气中放置时间过长 |
| B.盛装Ce(SO4)2标准溶液的滴定管未用标准溶液润洗 |
| C.锥形瓶中装待测液前未干燥 |
| D.滴定管内部滴定前无气泡,滴定后有气泡 |
您最近一年使用:0次
2024-04-02更新
|
558次组卷
|
4卷引用:题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)
(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)山西省太原市2024届高三一模理综试卷-高中化学河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题
2024·四川成都·二模
名校
4 . 实验室利用含钴废渣[含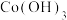 、
、 等]制备磁性材料
等]制备磁性材料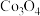 。回答下列问题:
。回答下列问题:
I.稀硫酸的配制。
(1)实验室里需要:450mL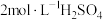 溶液,用98%浓硫酸(密度为
溶液,用98%浓硫酸(密度为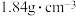 )配制该溶液时,所需的浓硫酸的体积为
)配制该溶液时,所需的浓硫酸的体积为_______ (保留1位小数)mL。
(2)下图关于容量瓶的操作,正确的是_______ 。
Ⅱ.浸取,将一定量的钴渣粉与 溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃通过仪器a缓慢滴加稀硫酸,充分反应,过滤。
溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃通过仪器a缓慢滴加稀硫酸,充分反应,过滤。_______ 作为最佳传热介质。
(5)该过程中,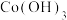 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
Ⅲ.沉钴。Co(Ⅱ)盐溶液可以形成 、
、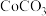 和
和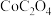 等多种形式的沉淀。
等多种形式的沉淀。
已知:向0.100mol/L溶液中滴加NaOH溶液调节pH, 时开始出现
时开始出现 沉淀。
沉淀。
(6)向除杂后的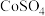 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到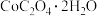 ,不能用同浓度的
,不能用同浓度的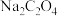 溶液代替
溶液代替 溶液的原因是
溶液的原因是_______ 。
Ⅳ.制备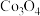 ,将所得的18.3g草酸钴晶体(
,将所得的18.3g草酸钴晶体(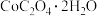 )高温灼烧,其热重分析图如图:
)高温灼烧,其热重分析图如图:_______ ,CD段发生反应的化学方程式为_______ 。
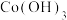 、
、 等]制备磁性材料
等]制备磁性材料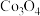 。回答下列问题:
。回答下列问题:I.稀硫酸的配制。
(1)实验室里需要:450mL
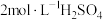 溶液,用98%浓硫酸(密度为
溶液,用98%浓硫酸(密度为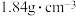 )配制该溶液时,所需的浓硫酸的体积为
)配制该溶液时,所需的浓硫酸的体积为(2)下图关于容量瓶的操作,正确的是
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.将溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.浸取,将一定量的钴渣粉与
 溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃通过仪器a缓慢滴加稀硫酸,充分反应,过滤。
溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃通过仪器a缓慢滴加稀硫酸,充分反应,过滤。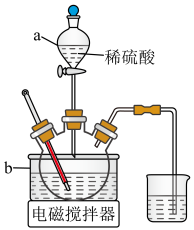
(5)该过程中,
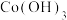 转化为
转化为 的离子方程式为
的离子方程式为Ⅲ.沉钴。Co(Ⅱ)盐溶液可以形成
 、
、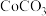 和
和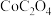 等多种形式的沉淀。
等多种形式的沉淀。已知:向0.100mol/L溶液中滴加NaOH溶液调节pH,
 时开始出现
时开始出现 沉淀。
沉淀。(6)向除杂后的
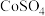 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到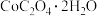 ,不能用同浓度的
,不能用同浓度的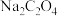 溶液代替
溶液代替 溶液的原因是
溶液的原因是Ⅳ.制备
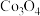 ,将所得的18.3g草酸钴晶体(
,将所得的18.3g草酸钴晶体(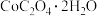 )高温灼烧,其热重分析图如图:
)高温灼烧,其热重分析图如图: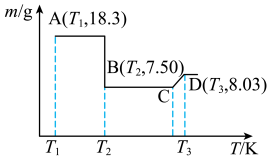
您最近一年使用:0次
2024-03-06更新
|
535次组卷
|
4卷引用:提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学 2024届四川省成都市第七中学高三下学期二诊模拟考试理综试卷-高中化学2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学
2024高三下·全国·专题练习
5 . 乙酰水杨酸(阿司匹林)是目前常用药物之一,实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
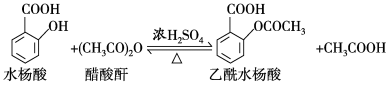
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤;
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤;
③滤液用浓盐酸酸化后冷却、过滤得固体;
④固体经纯化得白色的乙酰水杨酸晶体5.4 g;
回答下列问题:
(1)该合成反应中应采用___________加热(填字母)。
(2)①中需使用冷水,目的是___________ 。
(3)②中饱和碳酸氢钠的作用是___________ ,以便过滤除去难溶杂质。
(4)④采用的纯化方法为___________ 。
(5)本实验的产率是___________ %。

| 水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
| 熔点/℃ | 157~159 | -72~-74 | 135~138 |
| 相对密度/(g·cm-3) | 1.44 | 1.10 | 1.35 |
| 相对分子质量 | 138 | 102 | 180 |
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤;
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤;
③滤液用浓盐酸酸化后冷却、过滤得固体;
④固体经纯化得白色的乙酰水杨酸晶体5.4 g;
回答下列问题:
(1)该合成反应中应采用___________加热(填字母)。
| A.热水浴 | B.酒精灯 | C.煤气灯 | D.电炉 |
(3)②中饱和碳酸氢钠的作用是
(4)④采用的纯化方法为
(5)本实验的产率是
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
6 . 热重分析法测定结晶的含量:氮气气氛中以升温速率10℃/min测定某化合物(K2[Cu(C2O4)2]·nH2O)的热失重曲线,如图所示晶体在107℃失重10.2%,失去全部结晶水。
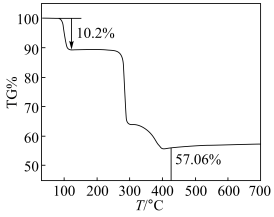
(1)通过热失重分析,蓝色晶体的化学式中n=___________ ,经过实验测定后,蓝色晶体的化学式为___________ 。
(2)加热400℃之后,剩余物质的质量不再发生变化。为探究剩余固体的成分,冷却后取少量固体于试管中,加水溶解有红色不溶物,过滤后向滤液中加入稀盐酸产生无色无味气体。则剩余固体的成分为___________ 。

(1)通过热失重分析,蓝色晶体的化学式中n=
(2)加热400℃之后,剩余物质的质量不再发生变化。为探究剩余固体的成分,冷却后取少量固体于试管中,加水溶解有红色不溶物,过滤后向滤液中加入稀盐酸产生无色无味气体。则剩余固体的成分为
您最近一年使用:0次
23-24高一上·辽宁朝阳·期末
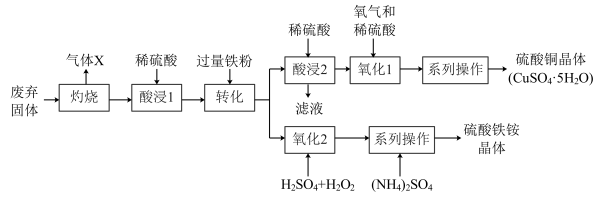
7 . 某实验小组同学利用某工业废弃矿石(主要成分为 和
和 ,其他成分不参与反应制备硫酸铜晶体与硫酸铁铵晶体,工艺流程如下图所示:
,其他成分不参与反应制备硫酸铜晶体与硫酸铁铵晶体,工艺流程如下图所示:
回答下列问题:
(1)气体X的名称为______ 。
(2)“酸浸1”过程中红色固体被溶解的化学方程式为______ 。
(3)“酸浸2”得到的滤液为______ (填主要物质的化学式)溶液,可以转移到______ 操作工序中循环利用。
(4)“氧化2”过程发生反应的离子方程式为____________ ,实际操作日所加 的量要比理论计算值多,可能原因是
的量要比理论计算值多,可能原因是____________ 。
(5)“系列操作”包括______ 、______ 、过滤、洗涤、干燥,该系列操作所需的仪器铁架台、酒精灯、玻璃棒、蒸发皿、烧杯和______ 。
(6)若称取25.6 kg废弃矿石经过上述流程最终得到25 kg硫酸铜晶体,则矿石中Cu元的质量分数为______ %(保留1位小数)。
 和
和 ,其他成分不参与反应制备硫酸铜晶体与硫酸铁铵晶体,工艺流程如下图所示:
,其他成分不参与反应制备硫酸铜晶体与硫酸铁铵晶体,工艺流程如下图所示:
回答下列问题:
(1)气体X的名称为
(2)“酸浸1”过程中红色固体被溶解的化学方程式为
(3)“酸浸2”得到的滤液为
(4)“氧化2”过程发生反应的离子方程式为
 的量要比理论计算值多,可能原因是
的量要比理论计算值多,可能原因是(5)“系列操作”包括
(6)若称取25.6 kg废弃矿石经过上述流程最终得到25 kg硫酸铜晶体,则矿石中Cu元的质量分数为
您最近一年使用:0次
23-24高三上·河南驻马店·期末
名校
解题方法
8 . 碱式硫酸镁晶须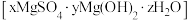 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含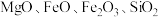 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
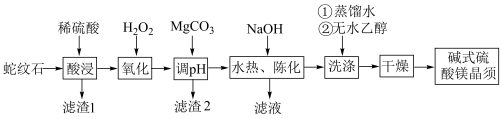
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是_______ 。
(2)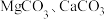 在高温下均易分解,但
在高温下均易分解,但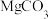 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:_______ 。
(3)洗涤步骤中用无水乙醇洗涤的目的是_______ 。
(4)氧化的目的是_______ (用离子方程式表示),为检验溶液中的离子是否完全被氧化,可使用的试剂为_______ (填化学式)。
(5)将碱式硫酸镁晶须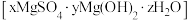 进行热重分析测定其化学式,
进行热重分析测定其化学式,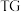 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为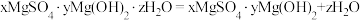 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
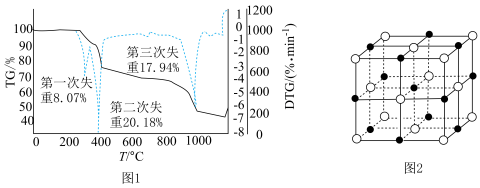
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为_______ ;第二次失重发生反应的化学方程式为_______ 。
②图2中的晶胞参数为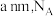 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为_______ ,该晶体的密度为_______  。
。
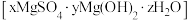 是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含
是一种无机镁盐晶须,将其添加到以橡胶、塑料为基体的复合材料中,能使该复合材料有良好的阻燃功效。一种以蛇纹石(主要含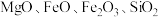 等)为原料制备碱式硫酸镁晶须的流程如图:
等)为原料制备碱式硫酸镁晶须的流程如图:
回答下列问题:
(1)酸浸时须将蛇纹石粉碎,其目的是
(2)
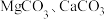 在高温下均易分解,但
在高温下均易分解,但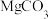 的分解温度比
的分解温度比 的低,试从结构角度解释其原因:
的低,试从结构角度解释其原因:(3)洗涤步骤中用无水乙醇洗涤的目的是
(4)氧化的目的是
(5)将碱式硫酸镁晶须
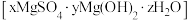 进行热重分析测定其化学式,
进行热重分析测定其化学式, 热重曲线[样品的固体残留率(
热重曲线[样品的固体残留率( )随温度变化]
)随温度变化] (微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为
(微商热重曲线,表示质量的变化速率随温度的变化)如图1所示,第一次失重发生反应的化学方程式为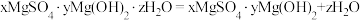 ,第三次失重后获得的晶体的晶胞结构如图2所示。
,第三次失重后获得的晶体的晶胞结构如图2所示。
①x、y、z为最简整数比,则碱式硫酸镁晶须的化学式为
②图2中的晶胞参数为
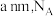 为阿伏加德罗常数的值,则晶胞中白球的配位数为
为阿伏加德罗常数的值,则晶胞中白球的配位数为 。
。
您最近一年使用:0次
2024-01-22更新
|
261次组卷
|
4卷引用:T28-工业流程题
23-24高三上·河南南阳·阶段练习
9 . 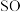 2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
(1)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开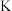 1和
1和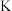 2,缓缓通入
2,缓缓通入 2,加热。实验后反应管A中残留的固体为红色粉末
2,加热。实验后反应管A中残留的固体为红色粉末
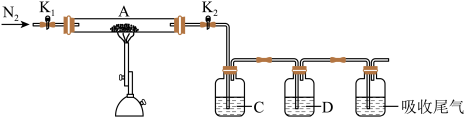
①装置C的溶液为_______ (填标号)。装置D可观察到的实验现象为_______ 。
a.品红 b.NaOH c.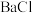 2 d.
2 d. e.浓硫酸
e.浓硫酸
②写出硫酸亚铁高温分解的化学方程式_______ 。
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性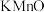 4溶液恰好褪色,停止实验。
4溶液恰好褪色,停止实验。
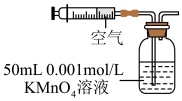
①二氧化硫和酸性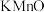 4溶液反应的离子方程式为
4溶液反应的离子方程式为_______ 。
②该空气中二氧化硫的体积分数为_______ (用含Ⅴ的代数式表示)。
(3)某化工厂用如图所示工艺流程除去燃煤产生的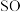 2。
2。

①过程I发生的反应中,氧化剂与还原剂的物质的量之比为_______ 。
②过程Ⅱ发生反应的化学方程式为_______ 。
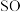 2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:(1)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开
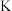 1和
1和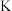 2,缓缓通入
2,缓缓通入 2,加热。实验后反应管A中残留的固体为红色粉末
2,加热。实验后反应管A中残留的固体为红色粉末
①装置C的溶液为
a.品红 b.NaOH c.
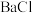 2 d.
2 d. e.浓硫酸
e.浓硫酸②写出硫酸亚铁高温分解的化学方程式
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性
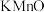 4溶液恰好褪色,停止实验。
4溶液恰好褪色,停止实验。
①二氧化硫和酸性
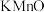 4溶液反应的离子方程式为
4溶液反应的离子方程式为②该空气中二氧化硫的体积分数为
(3)某化工厂用如图所示工艺流程除去燃煤产生的
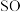 2。
2。
①过程I发生的反应中,氧化剂与还原剂的物质的量之比为
②过程Ⅱ发生反应的化学方程式为
您最近一年使用:0次
23-24高三上·四川内江·阶段练习
名校
解题方法
10 . 资源的高效利用对保护环境、促进经济持续健康发展具有重要作用,如回收利用电解精炼铜的阳极泥中含有的银、铂、金等贵重金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和___________ 。
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为___________ 。
(3)已知N2H4 被银氨溶液氧化的产物是氮气,则每生成1 mol Ag,需要消耗___________ g N2H4。
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4,在NaAuCl4中Au元素的化合价为___________ ,该反应的离子方程式为___________ 。
(5)阳极泥中的铜可以用FeCl3 溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合下图分析:(其中的纵坐标代表金属阳离子浓度的对数)___________ (用离子方程式表示),然后加入适量的CuO调节pH=3.7,除去___________ (离子);
②根据图中数据计算可得Cu(OH)2的Ksp约为___________ 。
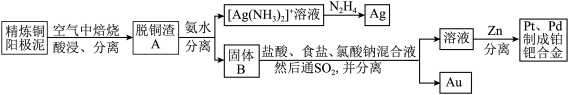
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为
(3)已知N2H4 被银氨溶液氧化的产物是氮气,则每生成1 mol Ag,需要消耗
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4,在NaAuCl4中Au元素的化合价为
(5)阳极泥中的铜可以用FeCl3 溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合下图分析:(其中的纵坐标代表金属阳离子浓度的对数)
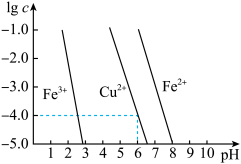
②根据图中数据计算可得Cu(OH)2的Ksp约为
您最近一年使用:0次



