2019高一·全国·专题练习
解题方法
1 . 根据所学知识回答下列问题:
(1)A与NaOH溶液反应,有如下转化关系(若产物中有水生成则省略,未表示出来)。

①若A为常见金属单质,C为气体,写出向B溶液中通入过量CO2反应的离子方程式________ ;
②若A为空气的成分之一,能造成温室效应,当向100mL1mol/LNaOH溶液中通入1.344L气体(标准状况下)充分反应后,生成B和C的物质的量之比为_____ (B的摩尔质量大于C);
③若A为AlCl3,写出A与NaOH按物质的量之比3:10混合时发生反应的离子方程式________ 。
(2)氯化铁溶液可用于腐蚀印刷铜电路板,请写出相关的离子方程式____________ ,如何检验溶液中的铁离子已经完全反应______________ 。
(3)现有AlCl3 和FeCl3混合溶液,其中A13+和Fe3+的物质的量之和为0.1mol,向此溶液中加入80mL浓度为4mol/L的NaOH溶液,使其充分反应,设原混合溶液中A13+的物质的量与A13+和Fe3+的总物质的量的比值为x。当最终生成的沉淀中只有Fe(OH)3时,x的取值范围是______ ,请在图中画出沉淀总量(mol)随x(0→1.0)变化的曲线____________ 。
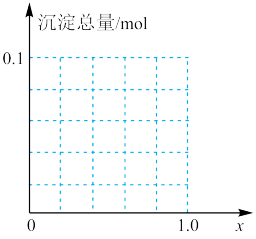
(1)A与NaOH溶液反应,有如下转化关系(若产物中有水生成则省略,未表示出来)。

①若A为常见金属单质,C为气体,写出向B溶液中通入过量CO2反应的离子方程式
②若A为空气的成分之一,能造成温室效应,当向100mL1mol/LNaOH溶液中通入1.344L气体(标准状况下)充分反应后,生成B和C的物质的量之比为
③若A为AlCl3,写出A与NaOH按物质的量之比3:10混合时发生反应的离子方程式
(2)氯化铁溶液可用于腐蚀印刷铜电路板,请写出相关的离子方程式
(3)现有AlCl3 和FeCl3混合溶液,其中A13+和Fe3+的物质的量之和为0.1mol,向此溶液中加入80mL浓度为4mol/L的NaOH溶液,使其充分反应,设原混合溶液中A13+的物质的量与A13+和Fe3+的总物质的量的比值为x。当最终生成的沉淀中只有Fe(OH)3时,x的取值范围是

您最近一年使用:0次
名校
2 . 某研究性学习小组同学为了探究“在相同的温度和压强下、相同体积的任何气体都含有相同数目和分子”,他们设计了如下实验装置并记录相关实验数据。实验装置:
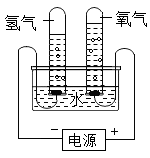
部分实验数据:
请回答下列问题:
(1)4分钟时H2、O2物质的量分别是__________ mol、___________ mol。
(2)该温度下,气体摩尔体积是________________ 。
(3)假设电解H2O速率相同,2分钟时试管内收集到的H2的体积是___________ mL。
(4)根据以上实验得出如下结论,其中不正确的是_________________ 。
A. 气体摩尔体积与气体的温度相关
B. 在该实验条件下,3 mol O2的气体摩尔体积为74.58 L/mol
C. 同温、同压下,2 mol O2和2 mol CO和CO2混合气体的体积相同
D. 该实验条件下,O2的密度为1.287 g/L

部分实验数据:
| 温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
| 30℃ | 101 kPa | 0 | 300 g | 0 | 0 |
| 30℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
(1)4分钟时H2、O2物质的量分别是
(2)该温度下,气体摩尔体积是
(3)假设电解H2O速率相同,2分钟时试管内收集到的H2的体积是
(4)根据以上实验得出如下结论,其中不正确的是
A. 气体摩尔体积与气体的温度相关
B. 在该实验条件下,3 mol O2的气体摩尔体积为74.58 L/mol
C. 同温、同压下,2 mol O2和2 mol CO和CO2混合气体的体积相同
D. 该实验条件下,O2的密度为1.287 g/L
您最近一年使用:0次
2018-08-14更新
|
236次组卷
|
2卷引用:2018年高一化学(人教版)必修1综合题型练习卷:化学计量在实验中的应用
名校
解题方法
3 . 今有一混合物的无色水溶液只可能含有以下离子中的若干种:K+、NH 、Fe2+、Cl-、Ca2+、Ba2+、CO
、Fe2+、Cl-、Ca2+、Ba2+、CO 、SO
、SO ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH 溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。综合上述实验,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是__________ 。
(2)该混合物中一定含有的离子是_________________ ;可能含有的离子是_______ 。
(3)计算K+的物质的量:n(K+)_________________ (具体值或取值范围)。
 、Fe2+、Cl-、Ca2+、Ba2+、CO
、Fe2+、Cl-、Ca2+、Ba2+、CO 、SO
、SO ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH 溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。综合上述实验,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)该混合物中一定含有的离子是
(3)计算K+的物质的量:n(K+)
您最近一年使用:0次
2018-01-01更新
|
644次组卷
|
3卷引用:《2018-2019学年同步单元双基双测AB卷》 第二单元 化学物质及其变化单元测试 B卷
(已下线)《2018-2019学年同步单元双基双测AB卷》 第二单元 化学物质及其变化单元测试 B卷河南省中原名校(即豫南九校)2017-2018学年高一上学期第二次联考化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期期中考试化学试题
2016高一·全国·课时练习
名校
4 . 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。

(1)A中试剂为___________________________________________ 。
(2)B中发生反应的化学方程式为______________________________________ 。
(3)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________ 。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________ (填“偏大”“偏小”或“不受影响”)。

(1)A中试剂为
(2)B中发生反应的化学方程式为
(3)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将
您最近一年使用:0次
2017-11-27更新
|
1507次组卷
|
8卷引用:【走进新高考】(人教版必修一)3.1.1金属的化学性质——金属与非金属、酸、水的反应 同步练习02
(已下线)【走进新高考】(人教版必修一)3.1.1金属的化学性质——金属与非金属、酸、水的反应 同步练习02(已下线)同步君 必修1 第3章 第1节 金属的化学性质高中化学人教版 必修1 第三章 金属及其化合物 1.金属的化学性质 金属的化学性质陕西省西安市远东第一中学2019届高三上学期期中考试化学试题(已下线)3.2.1 铁合金 铝和铝合金练习(1)——《高中新教材同步备课》(人教版 必修第一册)(已下线)第03章 铁 金属材料(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)3.2.1 铁合金 铝和铝合金(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)福建省泉州市第七中学2021-2022学年高一下学期期中考试化学试题
名校
5 . 氧化铜能与多种物质反应,能否与氨气(NH3)反应呢?在老师的指导下,某同学进行了探究。(注:无水硫酸铜遇水变蓝)
【实验设计】按图设计组装好仪器,检查气密性,装入药品。
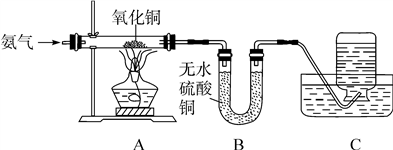
【进行实验】
(1)A中氧化铜全部转化成光亮的红色固体。
(2)B中U形管内物质变蓝。
(3)C中集气瓶内收集到一种无色气态单质,该气体用排水法收集的理由是_________________ 。
(4)从C中水槽里取适量液体于试管内,向试管里滴入无色酚酞溶液,溶液呈红色,原因是______________________________________________ 。
【实验结论】氧化铜和氨气发生反应,化学方程式是_______________________ 。
【继续探究】
(1)测得有关数据如下表:
在此反应中,参加反应的氧化铜的质量为________ g。
(2)A中玻璃管内的反应证明,氨气的化学性质与____________ (填物质化学式)有相似之处。
【实验设计】按图设计组装好仪器,检查气密性,装入药品。

【进行实验】
(1)A中氧化铜全部转化成光亮的红色固体。
(2)B中U形管内物质变蓝。
(3)C中集气瓶内收集到一种无色气态单质,该气体用排水法收集的理由是
(4)从C中水槽里取适量液体于试管内,向试管里滴入无色酚酞溶液,溶液呈红色,原因是
【实验结论】氧化铜和氨气发生反应,化学方程式是
【继续探究】
(1)测得有关数据如下表:
| 质量 | 实验前 | 实验后 |
| 氧化铜粉末+玻璃管 | 65.6g | 59.2g |
(2)A中玻璃管内的反应证明,氨气的化学性质与
您最近一年使用:0次
6 . 水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
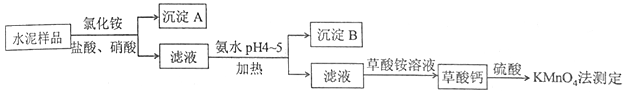
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是________________________________________ ,还可使用___________ 代替硝酸。
(2)沉淀A的主要成分是_________ ,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________ 。
(3)加氨水过程中加热的目的是______________________________________ 。沉淀B的主要成分为_____________ 、____________ (填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4-+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________ 。

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是
(2)沉淀A的主要成分是
(3)加氨水过程中加热的目的是
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4-+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为
您最近一年使用:0次
2017-08-08更新
|
9846次组卷
|
25卷引用:《考前20天终极攻略》-5月28日 工艺流程分析
(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第5讲 无机框图题的解答策略【教学案】百所名校联考-非金属及其化合物(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)专题四 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向10 碳、硅及其化合物-备战2022年高考化学一轮复习考点微专题(已下线)第11讲 碳、硅及无机非金属材料(练)-2023年高考化学一轮复习讲练测(全国通用)第四章 非金属及其化合物 第17讲 无机非金属材料2017年全国普通高等学校招生统一考试理综化学(新课标Ⅱ卷精编版)重庆市第二中学2018届高三3月测试化学试题西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题【全国百强校】宁夏回族自治区吴忠中学2019届高三上学期第三次月考(期中)化学试题陕西省吴起高级中学2019届高三上学期期中考试化学试题安徽省亳州市第二中学2018-2019学年高二下学期期中考试化学试题云南省漾濞二中2020届高三上学期开学考试化学试题贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题福建省福州第一中学2021届高三上学期期中考试化学试题宁夏石嘴山市第三中学2021届高三上学期第二次月考化学试题福建省长泰县第一中学2021届高三上学期11月考试化学试题云南省保山第九中学2021届高三上学期开学考试化学试题广东省广州市禺山高级中学2020-2021学年高二下学期第一阶段考试化学试题黑龙江省哈尔滨市第三中学2021-2022学年上学期高三第三次验收考试化学试题广东省佛山市第一中学2021-2022学年高一下学期第一次段考(3月)化学试题
真题
解题方法
7 . 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为MnO2+SO2 MnSO4。
MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化____ L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液pH范围为____ 。
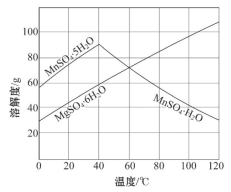
(3)下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为____ 。
(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中,加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)_____ 。
 MnSO4。
MnSO4。(1)质量为17.40 g纯净MnO2最多能氧化
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液pH范围为
(3)下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为
(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中,加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)
您最近一年使用:0次
2016-12-09更新
|
1262次组卷
|
4卷引用:2019高考备考一轮复习精品资料 第二章 化学物质及其变化第4讲 守恒思想在化学中的应用——守恒法解题技巧【教学案】
(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第4讲 守恒思想在化学中的应用——守恒法解题技巧【教学案】(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第3讲 化学计算中常用的几种方法【教学案】2020届人教版本高三化学第一轮复习第十章《化学实验热点》测试卷2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)
11-12高一·全国·课时练习
解题方法
8 . 你注意到汽车加油站内的标牌了吗?某些省市加油站提供的汽油标号由90#、93#换成了E90、E93,后者是在汽油中加入了10%的燃料乙醇而制得的乙醇汽油。燃料乙醇的生产过程可由下图表示:
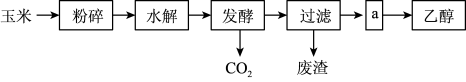
(1)粉碎玉米的目的是______ 。
(2)生产过程中为了检验淀粉水解是否完全,可使用的试剂是______ 。
(3)步骤a的操作是______(填字母)。
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:______ 、______ 。
(5)以玉米淀粉为原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+nH2O nC6H12O6
nC6H12O6
C6H12O6―→2C2H5OH+2CO2↑
根据上述反应式,可以算出100 kg淀粉理论上可生产无水乙醇______ kg。

(1)粉碎玉米的目的是
(2)生产过程中为了检验淀粉水解是否完全,可使用的试剂是
(3)步骤a的操作是______(填字母)。
| A.蒸发 | B.萃取 | C.蒸馏 | D.分液 |
(5)以玉米淀粉为原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+nH2O
 nC6H12O6
nC6H12O6C6H12O6―→2C2H5OH+2CO2↑
根据上述反应式,可以算出100 kg淀粉理论上可生产无水乙醇
您最近一年使用:0次
10-11高三上·湖南长沙·阶段练习
名校
解题方法
9 . 下图表示几种无机物之间的转化关系,其中A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。
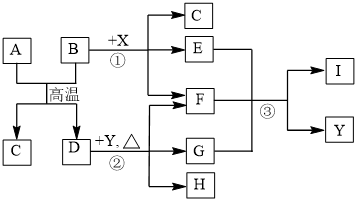
请回答下列问题:
(1)A的化学式是___ ,C的电子式是 __________ ,Y的名称是_____ 。
(2)反应①的化学方程式为__________________________ 。
(3)实验室测定气体E的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)_________________ 。
(4)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与_______ L O2(标准状况下)混合,恰好能被水完全吸收。

请回答下列问题:
(1)A的化学式是
(2)反应①的化学方程式为
(3)实验室测定气体E的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)
(4)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与
您最近一年使用:0次
2014·广东江门·一模
10 . 从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:

明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是_________________ 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________ 。
A.粉碎固体混合物 B.降低温度 C.不断搅拌 D.缩短浸泡时间
(3)从水浸后的滤液中得到K2SO4晶体的方法是__________ 。
(4)步骤③电解的化学方程式是_______________ ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:_________ 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是_________________________________ 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为______________________ 吨(列出计算表达式)。

明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S
 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是
(2)步骤②中,为提高浸出率,可采取的措施有
A.粉碎固体混合物 B.降低温度 C.不断搅拌 D.缩短浸泡时间
(3)从水浸后的滤液中得到K2SO4晶体的方法是
(4)步骤③电解的化学方程式是
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为
您最近一年使用:0次



