名校
解题方法
1 . 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为101kPa,温度为0℃).
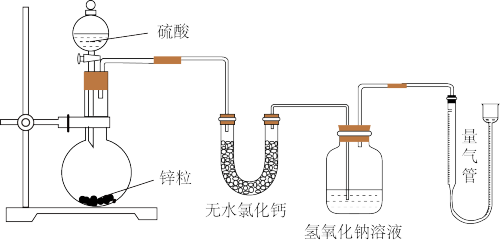
(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是___________ 。
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重1.28g,则圆底烧瓶中发生反应的化学方程式为________ 。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg量气管中收集到VmL气体,其依据得失电子守恒的原理,可得出a、b、V之间的关系为:是________ 。
(4)若在烧瓶中投入dg锌,再加入VLcmol/L浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重mg,则整个实验过程产生的混和气体中H2和SO2物质的量之比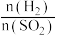 =
=________ (用含字母的代数式表示).若撤走盛有无水氯化钙的U形管,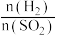 的比值将
的比值将________ (填偏大、偏小或无影响)。

(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重1.28g,则圆底烧瓶中发生反应的化学方程式为
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg量气管中收集到VmL气体,其依据得失电子守恒的原理,可得出a、b、V之间的关系为:是
(4)若在烧瓶中投入dg锌,再加入VLcmol/L浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重mg,则整个实验过程产生的混和气体中H2和SO2物质的量之比
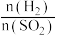 =
=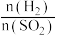 的比值将
的比值将
您最近一年使用:0次
2020-10-29更新
|
797次组卷
|
4卷引用:【教材实验热点】07 浓硫酸性质的探究
(已下线)【教材实验热点】07 浓硫酸性质的探究河南省许昌市第三中学2020-2021学年高一上学期质量检测化学试题(已下线)4.4.2 硫酸和硝酸的氧化性(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)江西省宁冈中学2022-2023学年高一上学期1月期末考试化学试题
名校
2 . 元素R所含的质子数与中子数相等,R的气态氢化物化学式为H2R.在标准状况下,8.5gH2R气体的体积是5.6L.
(1)求H2R的相对分子质量;
(2)推断R元素的名称;
(3)确定R在元素周期表中的具体位置.
(1)求H2R的相对分子质量;
(2)推断R元素的名称;
(3)确定R在元素周期表中的具体位置.
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
3 . Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的物质的量浓度。
(1)现需配制250mL0.100mol/L的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要__ 。
(2)需用托盘天平称取Na2S2O3固体的质量为__ g。
(3)另取废水50.00mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经过滤、洗涤后,用适量的稀盐酸溶解,此时CrO 全部转化为Cr2O
全部转化为Cr2O ;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O336.00mL,已知有关反应的离子方程式为①Cr2O
;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O336.00mL,已知有关反应的离子方程式为①Cr2O +6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O =2I-+S4O
=2I-+S4O 。求该工厂废水中Ba2+的物质的量浓度。(写出计算过程)
。求该工厂废水中Ba2+的物质的量浓度。(写出计算过程)___
(1)现需配制250mL0.100mol/L的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要
(2)需用托盘天平称取Na2S2O3固体的质量为
(3)另取废水50.00mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经过滤、洗涤后,用适量的稀盐酸溶解,此时CrO
 全部转化为Cr2O
全部转化为Cr2O ;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O336.00mL,已知有关反应的离子方程式为①Cr2O
;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O336.00mL,已知有关反应的离子方程式为①Cr2O +6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O;②I2+2S2O =2I-+S4O
=2I-+S4O 。求该工厂废水中Ba2+的物质的量浓度。(写出计算过程)
。求该工厂废水中Ba2+的物质的量浓度。(写出计算过程)
您最近一年使用:0次
4 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______ 离子通过,氯气的逸出口是_______ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____ mol;产生“气泡”的化学方程式为____________ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2020-07-08更新
|
12835次组卷
|
13卷引用:专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编
(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用(已下线)专题17 原理综合题2020年全国统一考试化学试题(新课标Ⅱ)四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题青海省湟川中学2020-2021学年高二下学期第一次月考化学试题山东省枣庄市第三中学2022届高三第一次月考化学试题2020年全国卷Ⅱ化学真题变式题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
5 . 某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mL 18mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
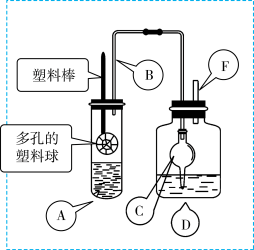
(1)请写出锌与硫酸反应产生SO2的化学方程式_______ 。
(2)在组装仪器之后,加入试剂之前必须进行的操作是__________ 。
(3)长导管B的作用是______ ,如果没有这个设计,最终测定的临界浓度会_______ 。(填“偏高”、“偏低”或“无影响”)
(4)装置中干燥管C的作用是_______ 。
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:_________ mol/L。(用含a的计算式表示,忽略体积变化)
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO 的物质的量计算临界浓度,你认为他的这一想法是否可行?
的物质的量计算临界浓度,你认为他的这一想法是否可行?______ (填“可行”或“不可行”),原因是_____ 。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。

(1)请写出锌与硫酸反应产生SO2的化学方程式
(2)在组装仪器之后,加入试剂之前必须进行的操作是
(3)长导管B的作用是
(4)装置中干燥管C的作用是
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO
 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO 的物质的量计算临界浓度,你认为他的这一想法是否可行?
的物质的量计算临界浓度,你认为他的这一想法是否可行?
您最近一年使用:0次
2020-07-03更新
|
499次组卷
|
4卷引用:第一单元 物质的量测试题-2021年高考化学一轮复习名师精讲练
(已下线)第一单元 物质的量测试题-2021年高考化学一轮复习名师精讲练(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记四川省阆中中学2020届高三全景模拟(最后一考)理综化学试题吉林省长春外国语学校2021届高三上学期期末考试化学试题
名校
解题方法
6 . 实验室欲使用 450 mL 0.2 mol•L-1 CuSO4 溶液,配制该溶液包含以下步骤:
①称取一定质量胆矾(CuSO4•5H2O)、放入烧杯,用适量蒸馏水将其完全溶解;
②把溶液小心地注入容量瓶中;
③继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm 时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3 次,每次洗涤液都转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞好,充分摇匀。
请填写下列空白:
(1)应该称取胆矾的质量是_________ 。
(2)上述操作的正确顺序是_________ 。
(3)实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒__________ 等。
(4)下列情况中会导致所配溶液浓度偏小的是_________ (填序号)。
a.容量瓶使用前未干燥
b.转移溶液后,烧杯没有洗涤
c.定容过程观察容量瓶内液面时,俯视刻度线
d.颠倒摇匀后,发现液面低于刻度线,不作任何处置
e.加蒸馏水时不慎超过刻度线,用胶头滴管小心地吸去超出部分,使凹液面底部与刻度线相切
(5)取 100 mL 所配溶液,向其中加入 1.68 g 铁粉,充分反应后,过滤,将固体洗涤、干燥后,再加入1 mol•L-1 稀硫酸至固体不再溶解。
试计算:
①至少需要稀硫酸_________ mL。
②固体溶解过程中产生氢气_________ mL(标准状况)。
①称取一定质量胆矾(CuSO4•5H2O)、放入烧杯,用适量蒸馏水将其完全溶解;
②把溶液小心地注入容量瓶中;
③继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm 时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3 次,每次洗涤液都转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞好,充分摇匀。
请填写下列空白:
(1)应该称取胆矾的质量是
(2)上述操作的正确顺序是
(3)实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒
(4)下列情况中会导致所配溶液浓度偏小的是
a.容量瓶使用前未干燥
b.转移溶液后,烧杯没有洗涤
c.定容过程观察容量瓶内液面时,俯视刻度线
d.颠倒摇匀后,发现液面低于刻度线,不作任何处置
e.加蒸馏水时不慎超过刻度线,用胶头滴管小心地吸去超出部分,使凹液面底部与刻度线相切
(5)取 100 mL 所配溶液,向其中加入 1.68 g 铁粉,充分反应后,过滤,将固体洗涤、干燥后,再加入1 mol•L-1 稀硫酸至固体不再溶解。
试计算:
①至少需要稀硫酸
②固体溶解过程中产生氢气
您最近一年使用:0次
解题方法
7 . 氢溴酸常用于合成镇静剂和麻醉剂等医药用品。已知: 液溴是易挥发的深红棕色液体,沸点为58.78℃。质量分数为47%的氢溴酸是易挥发的无色液体,沸点 为 126℃. 实验室制备质量分数为47%的氢溴酸的一种方法如下。回答下列问题:
(2)操作 II的蒸馏装置如图所示(部分夹持装置省略),仪器a的名称是_________ ,装置中除缺石棉网外还有两处明显错误,分别是_________ 、 _______________ 。
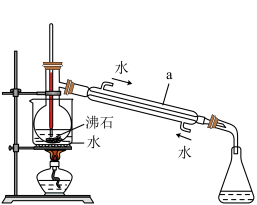
(3)操作III加入适量Na2SO3发生反应的离子方程式为__________ 。
(4)工业生产制得的氢溴酸常常有淡淡的黄色, 有同学推测是因为含Fe3+,可用试剂__________ 检验。若观察到的现象为________ ,则推测正确。
(5)质量分数为 47%的氢溴酸的产率为__________ 。
实验橾作 | 现象 |
| I .向锥形瓶中依次加入适量冰水、m1g 液溴,再通入SO2充分反应 | 得到淡黄色溶液 |
| II. 将操作 I 所得溶液转移至蒸馏烧瓶,蒸馏 | 锥形瓶中得橙黄色粗产品 |
| III.在不断搅拌下,向锥形瓶中加入适量Na2SO3溶液 | (1)① |
| IV.继续加入适量 Ba(OH)2溶液 | ② |
| V.过滤,滤液经蒸馏后得质量分数为47%的氢溴酸m2g |

(3)操作III加入适量Na2SO3发生反应的离子方程式为
(4)工业生产制得的氢溴酸常常有淡淡的黄色, 有同学推测是因为含Fe3+,可用试剂
(5)质量分数为 47%的氢溴酸的产率为
您最近一年使用:0次
2020高三·全国·专题练习
8 . 无水MgBr2可用作催化剂。请回答:
为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++ Y4-==Mg Y2-
①滴定前润洗滴定管的操作方法是__________ 。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________ (以质量分数表示)。
为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++ Y4-==Mg Y2-
①滴定前润洗滴定管的操作方法是
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是
您最近一年使用:0次
名校
解题方法
9 . 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。
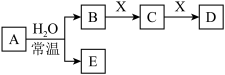
(1)若A是常温下的气态单质,X是Na2CO3,则D与A的水溶液反应的化学方程式为:_____________________________________ 。
(2)若E为难溶于水的白色沉淀,B与X的反应是中学化学中重要的化工反应:写出D与水反应所得的稀溶液与铜片反应的离子方程式________________________ 。
(3)若D为白色沉淀,且与A的摩尔质量相等,
(a)A的电子式__________ 。写出X与C反应生成D的离子方程式___________ 。
(b)将NaHCO3分解产生的气体用足量的A充分吸收得到固体混合物甲,将甲溶于VmLCmol·L- 的盐酸中,产生无色混合气体乙,溶液呈中性,则A的物质的量为__________ mol,混合气体乙的物质的量为___ mol。

(1)若A是常温下的气态单质,X是Na2CO3,则D与A的水溶液反应的化学方程式为:
(2)若E为难溶于水的白色沉淀,B与X的反应是中学化学中重要的化工反应:写出D与水反应所得的稀溶液与铜片反应的离子方程式
(3)若D为白色沉淀,且与A的摩尔质量相等,
(a)A的电子式
(b)将NaHCO3分解产生的气体用足量的A充分吸收得到固体混合物甲,将甲溶于VmLCmol·L- 的盐酸中,产生无色混合气体乙,溶液呈中性,则A的物质的量为
您最近一年使用:0次
10 . 青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157 ℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35 ℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:
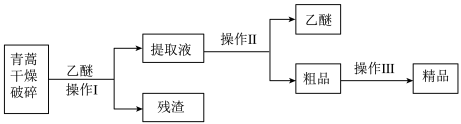
(1)对青蒿进行干燥破碎的目的是_____ 。
(2)操作Ⅰ需要的玻璃仪器主要有烧杯、___ ,操作Ⅱ的名称是______ 。
(3)操作Ⅲ的主要过程可能是____ (填字母)。
A 加水溶解,蒸发浓缩、冷却结晶
B 加95%的乙醇,浓缩、结晶、过滤
C 加入乙醚进行萃取分液
(4)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2 g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
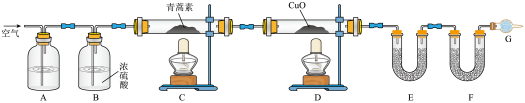
①装置A、E、F中盛放的物质分别是_____ 、___ 、____ 。
②G的作用是_______ 。
③
则测得青蒿素的最简式是____ ,欲确定其分子式,则还需要的物理量为___ 。

(1)对青蒿进行干燥破碎的目的是
(2)操作Ⅰ需要的玻璃仪器主要有烧杯、
(3)操作Ⅲ的主要过程可能是
A 加水溶解,蒸发浓缩、冷却结晶
B 加95%的乙醇,浓缩、结晶、过滤
C 加入乙醚进行萃取分液
(4)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2 g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置A、E、F中盛放的物质分别是
②G的作用是
③
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
您最近一年使用:0次



