2022高一·上海·专题练习
解题方法
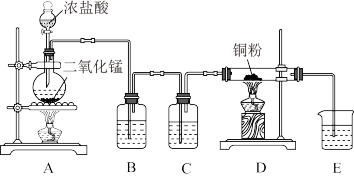
1 . 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。请回答下列问题:
已知:MnO2 + 4HCl(浓) MnCl2 + Cl2↑+2H2O
MnCl2 + Cl2↑+2H2O
(1)B中选用的试剂是_______ ,其作用是_______ ;C 中选用的试剂是_______ ,其作用是_______ 。
(2)装置E的目的是_______ ,写出 E 中发生反应的化学方程式:_______ 。
(3)但实验发现D中得到的无水CuCl2总是偏蓝色,请你提出改进方案:_______ 。
(4)为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:
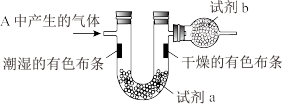
试剂a应选择_______ ;试剂b应选择_______ 。(填序号)
① 无水氯化钙 ② 浓硫酸
③ 碱石灰 ④ 硫酸铜粉末
(5)将实验产生的标况下6.72L氯气通入到500mL一定物质的量浓度的氢氧化钠溶液中,恰好完全反应。则:
① 该氢氧化钠溶液的浓度是_______
② 生成次氯酸钠的质量是_______

已知:MnO2 + 4HCl(浓)
 MnCl2 + Cl2↑+2H2O
MnCl2 + Cl2↑+2H2O(1)B中选用的试剂是
(2)装置E的目的是
(3)但实验发现D中得到的无水CuCl2总是偏蓝色,请你提出改进方案:
(4)为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:
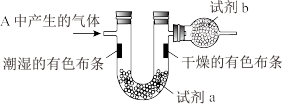
试剂a应选择
① 无水氯化钙 ② 浓硫酸
③ 碱石灰 ④ 硫酸铜粉末
(5)将实验产生的标况下6.72L氯气通入到500mL一定物质的量浓度的氢氧化钠溶液中,恰好完全反应。则:
① 该氢氧化钠溶液的浓度是
② 生成次氯酸钠的质量是
您最近一年使用:0次
名校
解题方法
2 . 四水醋酸锰[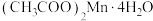 ]用于染色催化剂和分析试剂等。
]用于染色催化剂和分析试剂等。
(1)以四水醋酸锰为电解液,控制适当电压电解,降低温度后减压抽滤,用乙酸洗涤干燥,制得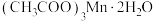 。将
。将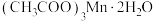 在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
①第一阶段释放出2种等物质的量的物质,它们的分子式分别为_______ 。
②剩余物B的化学式为_______ 。
(2)用四水醋酸锰和乙酰氯(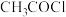 )为原料制备无水二氯化锰流程如下:
)为原料制备无水二氯化锰流程如下:
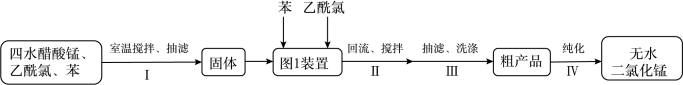
已知:a无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸、不溶于苯。
b.制备无水二氯化锰的主要反应: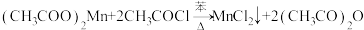
c.乙酰氯遇水发生反应: 。
。
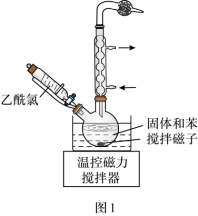
请回答:
①步骤Ⅰ所获固体主要成分是_______ (用化学式表示)。
②步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,加热回流的目的是_______ 。
③测定无水 的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 ,使
,使 氧化为
氧化为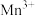 。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[
。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[ ]滴定
]滴定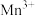 ,滴定过程中发生的反应为:
,滴定过程中发生的反应为: ,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是
,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是_______ 。样品中 的质量分数多少(写出计算过程)。
的质量分数多少(写出计算过程)。_______
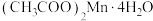 ]用于染色催化剂和分析试剂等。
]用于染色催化剂和分析试剂等。(1)以四水醋酸锰为电解液,控制适当电压电解,降低温度后减压抽滤,用乙酸洗涤干燥,制得
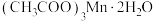 。将
。将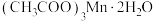 在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。| 阶段 | 热效应 | 剩余物 | 失重 |
| Ⅰ | 吸热 | A | 29.1% |
| Ⅱ | 放热 | B | 70.5% |
②剩余物B的化学式为
(2)用四水醋酸锰和乙酰氯(
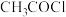 )为原料制备无水二氯化锰流程如下:
)为原料制备无水二氯化锰流程如下:
已知:a无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸、不溶于苯。
b.制备无水二氯化锰的主要反应:
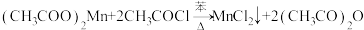
c.乙酰氯遇水发生反应:
 。
。
请回答:
①步骤Ⅰ所获固体主要成分是
②步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,加热回流的目的是
③测定无水
 的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 ,使
,使 氧化为
氧化为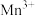 。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[
。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[ ]滴定
]滴定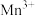 ,滴定过程中发生的反应为:
,滴定过程中发生的反应为: ,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是
,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是 的质量分数多少(写出计算过程)。
的质量分数多少(写出计算过程)。
您最近一年使用:0次
2022高一·上海·专题练习
解题方法
3 . 某碳酸钠样品中含有少量硫酸钠和氯化钠。某实验小组设计实验方案检验样品中的阴离子。请按照实验步骤补充实验所需的试剂及实验结论。
(1)步骤1:取样品配成溶液,向溶液中加入过量_______ ,产生使澄清石灰水变浑浊的气体,证明样品中含有_______ (填离子符号)。
(2)步骤2:继续向溶液中加入过量_______ ,产生白色沉淀,证明样品中含有_______ (填离子符号)。
(3)步骤3:过滤后,向滤液中加入少量_______ ,产生白色沉淀,证明样品中含有_______ (填离子符号)。
(4)实验小组的同学称取的样品为5.559 g,在实验2中得到沉淀的质量为0.233 g,实验3中得到的沉淀质量为0.287 g,则样品中含杂质硫酸钠的物质的量为_______ ,实验1中生成的气体在标准状况下的体积为_______ 。
(1)步骤1:取样品配成溶液,向溶液中加入过量
(2)步骤2:继续向溶液中加入过量
(3)步骤3:过滤后,向滤液中加入少量
(4)实验小组的同学称取的样品为5.559 g,在实验2中得到沉淀的质量为0.233 g,实验3中得到的沉淀质量为0.287 g,则样品中含杂质硫酸钠的物质的量为
您最近一年使用:0次
2022高一·上海·专题练习
4 . 二氧化碳是碳循环中的重要一员,具有广泛的应用价值。
(1)二氧化碳是植物生长必需的物质。草莓大棚中可通过燃烧木炭提供所需的二氧化碳,该反应的化学方程式是_______ 。
(2)实验室制备二氧化碳时,利用下列仪器组装发生装置。
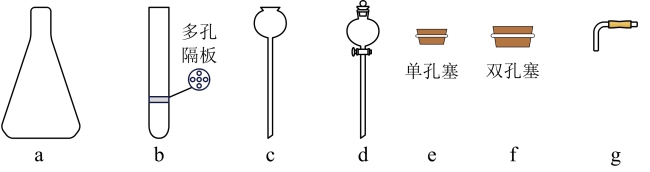
I.实验室制取二氧化碳的方程式为_______ 。
II.选择上述bcfg连接_______ (填“能”或“不能”)实现控制反应的发生与停止。
III.选择上图中a和_______ 组合发生装置,可以使反应平稳进行。
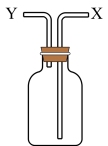
IV.可用下图装置收集CO2时,空气从_______ (填“x”或“y”)排出;验满的方法是_______ 。
(3)工业上利用煅烧大石灰石或酒精(C2H5OH)发酵制二氧化碳。酒精燃烧的方程式为:C2H5OH+3O2 2CO2+3H2O,若消耗1.5mol氧气,可产生二氧化碳
2CO2+3H2O,若消耗1.5mol氧气,可产生二氧化碳_______ g;实验室不用该反应制取二氧化碳的原因是_______ 。
(1)二氧化碳是植物生长必需的物质。草莓大棚中可通过燃烧木炭提供所需的二氧化碳,该反应的化学方程式是
(2)实验室制备二氧化碳时,利用下列仪器组装发生装置。

I.实验室制取二氧化碳的方程式为
II.选择上述bcfg连接
III.选择上图中a和
IV.可用下图装置收集CO2时,空气从

(3)工业上利用煅烧大石灰石或酒精(C2H5OH)发酵制二氧化碳。酒精燃烧的方程式为:C2H5OH+3O2
 2CO2+3H2O,若消耗1.5mol氧气,可产生二氧化碳
2CO2+3H2O,若消耗1.5mol氧气,可产生二氧化碳
您最近一年使用:0次
2022高一·上海·专题练习
5 . 根据下列实验装置图,回答有关问题。
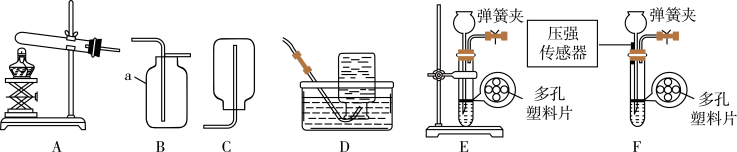
(1)仪器a的名称是:_______ 。
(2)实验室用A装置制备氧气的化学方程式为_______ ;欲收集一瓶较纯净的氧气,可选择的收集装置是_______ (填装置编号)。
(3)E是实验室制备二氧化碳气体的发生装置,请写出反应的化学方程式_______ 。该装置的优点是_______ 。若在装置E中连接压强传感器(如图F),测定实验中试管内气体压强变化的情况(如下图)。压强变化与实验现象或操作相对应的是_______ (填序号)。

(4)实验室以锌和稀硫酸为原料,_______ (填“能”或“不能”)用E装置制氢气,若要制取0.1mol的氢气,需要9.8%的稀硫酸_______ 克?(根据化学方程式计算)

(1)仪器a的名称是:
(2)实验室用A装置制备氧气的化学方程式为
(3)E是实验室制备二氧化碳气体的发生装置,请写出反应的化学方程式

| 序号 | 图象 | 实验现象或操作 |
| I | a-b | 试管中液面逐渐上升 |
| II | b-c | 大理石与稀盐酸脱离接触 |
| III | c-d | 打开弹簧夹 |
您最近一年使用:0次
名校
6 . Na2S2O4(保险粉)是一种强还原剂,锌粉法制备Na2S2O4,涉及部分原理如下:2SO2 +Zn ZnS2O4。制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
ZnS2O4。制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
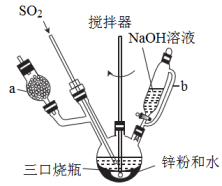
(1)仪器a中盛放的药品是___________ (填名称)。
(2)实验开始前,需要向三口烧瓶中充满N2,目的是___________ 。
(3)制备ZnS2O4时, 三口烧瓶的加热方式是___________ 。
(4)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后,过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤,酒精洗涤及干燥得产品。该步生成产品的化学方程式是___________ 。
(5)加入NaCl固体的作用是___________ , 酒精洗涤的目的是___________ 。
(6)取ag产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用cmol·L-1的K3[Fe(CN)6]标准溶液滴定,至终点时消耗K3[Fe(CN)6]标准溶液V mL。已知: [Fe(CN)6]3-被还原为[Fe(CN)6]4+,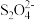 被氧化为
被氧化为 。产品中Na2S2O4的质量分数为
。产品中Na2S2O4的质量分数为___________ (列出计算式)。
 ZnS2O4。制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
ZnS2O4。制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
(1)仪器a中盛放的药品是
(2)实验开始前,需要向三口烧瓶中充满N2,目的是
(3)制备ZnS2O4时, 三口烧瓶的加热方式是
(4)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后,过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤,酒精洗涤及干燥得产品。该步生成产品的化学方程式是
(5)加入NaCl固体的作用是
(6)取ag产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用cmol·L-1的K3[Fe(CN)6]标准溶液滴定,至终点时消耗K3[Fe(CN)6]标准溶液V mL。已知: [Fe(CN)6]3-被还原为[Fe(CN)6]4+,
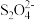 被氧化为
被氧化为 。产品中Na2S2O4的质量分数为
。产品中Na2S2O4的质量分数为
您最近一年使用:0次
7 . 高纯超细氧化铝是一种新型无机功能材料,以硫酸铵和硫酸铝为原料制备复盐硫酸铝铵[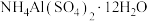 ],经硫酸铝铵热分解可制得高纯超细氧化铝,其流程如下:
],经硫酸铝铵热分解可制得高纯超细氧化铝,其流程如下:
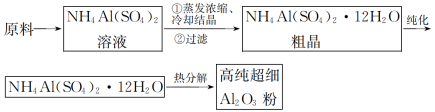
(1)操作①需加入稀 ,其目的是
,其目的是_______ ,“纯化”的方法为_______ 。
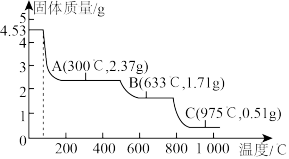
(2)取4.53g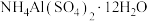 加热分解,最终剩余0.51g
加热分解,最终剩余0.51g 固体。加热过程中固体质量随温度的变化如图所示。写出硫酸铝铵晶体在633℃分解产生的固体的化学式:
固体。加热过程中固体质量随温度的变化如图所示。写出硫酸铝铵晶体在633℃分解产生的固体的化学式:_______ 。
(3)实验室以 和
和 为原料,在一定条件下反应生成制备纳米
为原料,在一定条件下反应生成制备纳米 的前驱体
的前驱体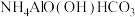 和
和 等物质,
等物质,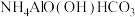 高温分解即得超细氧化铝。写出生成
高温分解即得超细氧化铝。写出生成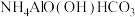 沉淀的化学方程式:
沉淀的化学方程式:_______ 。
(4)为了测定高纯超细氧化铝粉中 的质量分数,可用EDTA标准溶液滴定。取0.2040g氧化铝粉溶于盐酸,加入过量的30.00mL
的质量分数,可用EDTA标准溶液滴定。取0.2040g氧化铝粉溶于盐酸,加入过量的30.00mL EDTA标准溶液并加热煮沸,充分反应后,再用
EDTA标准溶液并加热煮沸,充分反应后,再用 的
的 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液体积为5.00mL。已知
标准溶液体积为5.00mL。已知 、
、 与EDTA反应的化学计量比均为1:1。
与EDTA反应的化学计量比均为1:1。
①加入过量的EDTA标准溶液并加热煮沸的原因是_______ 。
②计算 的质量分数
的质量分数_________ (写出计算过程)。
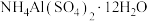 ],经硫酸铝铵热分解可制得高纯超细氧化铝,其流程如下:
],经硫酸铝铵热分解可制得高纯超细氧化铝,其流程如下:
(1)操作①需加入稀
 ,其目的是
,其目的是(2)取4.53g
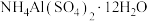 加热分解,最终剩余0.51g
加热分解,最终剩余0.51g 固体。加热过程中固体质量随温度的变化如图所示。写出硫酸铝铵晶体在633℃分解产生的固体的化学式:
固体。加热过程中固体质量随温度的变化如图所示。写出硫酸铝铵晶体在633℃分解产生的固体的化学式:
(3)实验室以
 和
和 为原料,在一定条件下反应生成制备纳米
为原料,在一定条件下反应生成制备纳米 的前驱体
的前驱体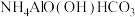 和
和 等物质,
等物质,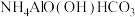 高温分解即得超细氧化铝。写出生成
高温分解即得超细氧化铝。写出生成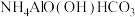 沉淀的化学方程式:
沉淀的化学方程式:(4)为了测定高纯超细氧化铝粉中
 的质量分数,可用EDTA标准溶液滴定。取0.2040g氧化铝粉溶于盐酸,加入过量的30.00mL
的质量分数,可用EDTA标准溶液滴定。取0.2040g氧化铝粉溶于盐酸,加入过量的30.00mL EDTA标准溶液并加热煮沸,充分反应后,再用
EDTA标准溶液并加热煮沸,充分反应后,再用 的
的 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液体积为5.00mL。已知
标准溶液体积为5.00mL。已知 、
、 与EDTA反应的化学计量比均为1:1。
与EDTA反应的化学计量比均为1:1。①加入过量的EDTA标准溶液并加热煮沸的原因是
②计算
 的质量分数
的质量分数
您最近一年使用:0次
2022高一·上海·专题练习
解题方法
8 . 实验室用电石和水反应制备的乙炔气体中含有少量的H2S气体,为了净化和检验乙炔气体,并通过测定乙炔的体积计算电石的纯度,按下列要求填空(注意X溶液为含溴3.2%的CCl4溶液105g)。
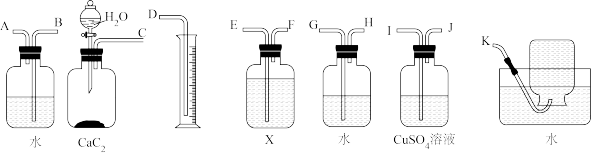
(1)试从如图所示的装置中选用几种必要的并把它们连成一套装置,这些被选用的装置的连接顺序是_______ (填序号)。
(2)实验室能否用启普发生器制乙炔,其原因是_______ 。
(3)为了得到比较平稳的乙炔气流,常用_______ 代替水。
(4)假设溴水与乙炔完全反应,生成C2H2Br4,用W g的电石与水反应后,测得排入量筒内的液体体积为V ml(标准状况),则电石纯度计算式为_______ 。

(1)试从如图所示的装置中选用几种必要的并把它们连成一套装置,这些被选用的装置的连接顺序是
(2)实验室能否用启普发生器制乙炔,其原因是
(3)为了得到比较平稳的乙炔气流,常用
(4)假设溴水与乙炔完全反应,生成C2H2Br4,用W g的电石与水反应后,测得排入量筒内的液体体积为V ml(标准状况),则电石纯度计算式为
您最近一年使用:0次
解题方法
9 . 苯乙酮(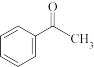 )是一种重要的化工原料,可用于制造香皂和塑料的增塑剂。其实验室制备流程和有关数据如下所示:
)是一种重要的化工原料,可用于制造香皂和塑料的增塑剂。其实验室制备流程和有关数据如下所示:
| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度g/mL | 溶解度 |
| 乙酸酐 | 102 | -73 | 140 | 1.082 | 微溶于水,易水解 |
| 苯 | 78 | 5.5 | 80.5 | 0.879 | 不溶水 |
| 苯乙酮 | 120 | 20.5 | 202 | 1.028 | 微溶水 |
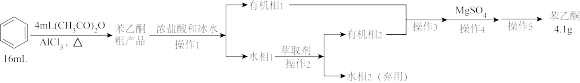
(1)制备苯乙酮粗产品的装置如图所示(加热和夹持装置已略去)。

②无水
 固体的作用是
固体的作用是(2)从绿色化学角度考虑,操作2中萃取剂宜采用_______。
| A.乙醇 | B.乙酸乙酯 | C.苯 | D.乙醚 |
(4)操作4中加入无水
 的目的是
的目的是(5)将操作5(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,
(6)本实验苯乙酮的产率最接近于_______。
| A.80% | B.70% | C.60% | D.50% |
您最近一年使用:0次
解题方法
10 . 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:
I.探究反应产生的气体成分。
(1)经检验反应产生的气体有H2,实验室检验H2的方法为_______ 。
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
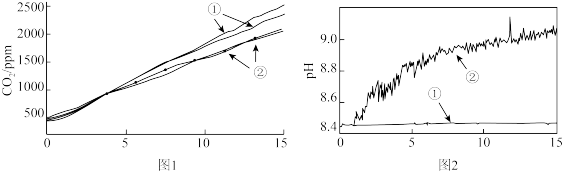
图1中曲线②对应的CO2含量逐渐增大的原因为_______ (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为_______ 。
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:
(3)结合实验1和4,可知溶液中的HCO 加快了反应的发生。
加快了反应的发生。
①实验4中横线处内容为_______ 。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO 能加快该反应的原因为
能加快该反应的原因为_______ 。
III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为_______ (填字母编号)。

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=_______ 。
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
(1)经检验反应产生的气体有H2,实验室检验H2的方法为
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
| 实验序号 | 实验操作 |
| 2 | 分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
| 3 | 分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |

图1中曲线②对应的CO2含量逐渐增大的原因为
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO
 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:| 实验序号 | 实验操作 | 实验现象 |
| 4 | 向_______溶液中加入长3 cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
 加快了反应的发生。
加快了反应的发生。①实验4中横线处内容为
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO
 能加快该反应的原因为
能加快该反应的原因为III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=
您最近一年使用:0次
2022-04-09更新
|
1140次组卷
|
7卷引用:专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)
(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)化学-2022年高考押题预测卷01(福建卷)(已下线)化学-2022年高考押题预测卷03(山东卷)(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)



