2023高三·全国·专题练习
解题方法
1 . 三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)简称“三盐”,不溶于水及有机溶剂。主要适用于不透明的聚氯乙烯硬质管、注射成型制品,也可用于人造革等软质制品。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示
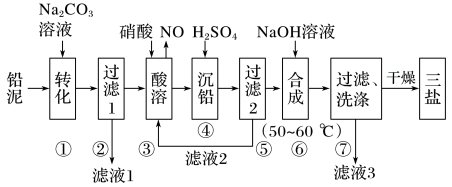
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13
请回答下列问题:
(1)写出步骤①“转化”的离子方程式:_______ 。
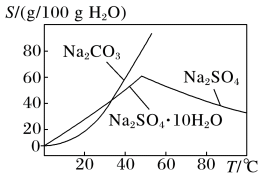
(2)根据下图溶解度曲线,由滤液1得到Na2SO4固体的操作为:将“滤液1”_______ 、_______ 、用乙醇洗涤后干燥。
(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是_______ (任意写出一条)。
(4)“滤液2”中可循环利用的溶质为_______ (填化学式)。若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO )=
)=_______ mol·L-1。
(5)步骤⑥“合成”三盐的化学方程式为_______ 。
(6)若消耗100.0 t铅泥,最终得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有75%转化为三盐,则铅泥中铅元素的质量分数为_______ 。

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13
请回答下列问题:
(1)写出步骤①“转化”的离子方程式:
(2)根据下图溶解度曲线,由滤液1得到Na2SO4固体的操作为:将“滤液1”

(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是
(4)“滤液2”中可循环利用的溶质为
 )=
)=(5)步骤⑥“合成”三盐的化学方程式为
(6)若消耗100.0 t铅泥,最终得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有75%转化为三盐,则铅泥中铅元素的质量分数为
您最近一年使用:0次
2 . 硫氰化钾(KSCN)的用途非常广泛,如用KSCN溶液检验 。实验室可用如下装置制取KSCN。
。实验室可用如下装置制取KSCN。
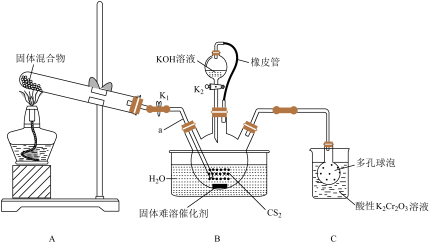
请回答下列问题:
(1)橡皮管的作用是_______ 。
(2)A装置是氨气发生装置,试管中的固体混合物为_______ (填化学式)。
(3)导管a插入 中的目的是
中的目的是_______ 。
(4)水浴加热B装置,三颈烧瓶中的反应除了生成 外,还生成了另一种酸式盐,其反应方程式为
外,还生成了另一种酸式盐,其反应方程式为_______ 。
(5)当三颈烧瓶中的液体不出现分层时,熄灭酒精灯,关闭 ,继续水浴加热(保持100℃),待酸式盐完全分解(保持100℃),再打开
,继续水浴加热(保持100℃),待酸式盐完全分解(保持100℃),再打开 ,继续水浴加热,就可以得到KSCN溶液。若要制取KSCN晶体,需进行的操作是:先将三颈烧瓶中的混合物进行
,继续水浴加热,就可以得到KSCN溶液。若要制取KSCN晶体,需进行的操作是:先将三颈烧瓶中的混合物进行_______ 、再将滤液蒸发浓缩、冷却结晶、过滤、_______ 、干燥。
(6)装置C中酸性 溶液的作用是
溶液的作用是_______ ;若三颈烧瓶中挥发出来的含硫物质恰好与200mL 2.0mol/L的 溶液反应,其中50%的硫元素转化为+6价硫,其余都转化为零价硫,理论上可制得KSCN质量为
溶液反应,其中50%的硫元素转化为+6价硫,其余都转化为零价硫,理论上可制得KSCN质量为_______ g。
 。实验室可用如下装置制取KSCN。
。实验室可用如下装置制取KSCN。
请回答下列问题:
(1)橡皮管的作用是
(2)A装置是氨气发生装置,试管中的固体混合物为
(3)导管a插入
 中的目的是
中的目的是(4)水浴加热B装置,三颈烧瓶中的反应除了生成
 外,还生成了另一种酸式盐,其反应方程式为
外,还生成了另一种酸式盐,其反应方程式为(5)当三颈烧瓶中的液体不出现分层时,熄灭酒精灯,关闭
 ,继续水浴加热(保持100℃),待酸式盐完全分解(保持100℃),再打开
,继续水浴加热(保持100℃),待酸式盐完全分解(保持100℃),再打开 ,继续水浴加热,就可以得到KSCN溶液。若要制取KSCN晶体,需进行的操作是:先将三颈烧瓶中的混合物进行
,继续水浴加热,就可以得到KSCN溶液。若要制取KSCN晶体,需进行的操作是:先将三颈烧瓶中的混合物进行(6)装置C中酸性
 溶液的作用是
溶液的作用是 溶液反应,其中50%的硫元素转化为+6价硫,其余都转化为零价硫,理论上可制得KSCN质量为
溶液反应,其中50%的硫元素转化为+6价硫,其余都转化为零价硫,理论上可制得KSCN质量为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 了测定Na2CS3溶液的浓度,按图装置进行实验,将35.0mLNa2CS3溶液置于装置A的三颈瓶中,打开仪器d的活塞,滴入足量2.0mol•L-1H2SO4,关闭活塞。
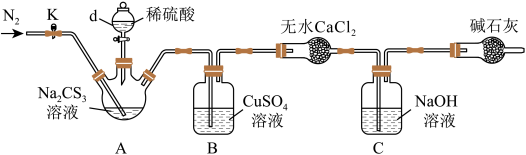
已知:CS +2H+=CS2+H2S↑,CS2和H2S均有毒,CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
+2H+=CS2+H2S↑,CS2和H2S均有毒,CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(1)反应开始时需要先通入一段时间N2,其作用为______ 。
(2)B中发生反应的离子方程式是_____ 。
(3)反应结束后打开止水夹K,再缓慢通入热N2一段时间,其目的是______ 。
(4)为了计算三硫代碳酸钠溶液的浓度,可测定B中生成沉淀的质量。称量B中沉淀质量之前需要进行的实验操作名称是______ ,若B中生成沉淀的质量为8.4g,则35.0mL三硫代碳酸钠溶液的物质的量浓度是_____ 。
(5)若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值____ (填“偏高”“偏低”或“无影响”),原因是_____ 。

已知:CS
 +2H+=CS2+H2S↑,CS2和H2S均有毒,CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
+2H+=CS2+H2S↑,CS2和H2S均有毒,CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。(1)反应开始时需要先通入一段时间N2,其作用为
(2)B中发生反应的离子方程式是
(3)反应结束后打开止水夹K,再缓慢通入热N2一段时间,其目的是
(4)为了计算三硫代碳酸钠溶液的浓度,可测定B中生成沉淀的质量。称量B中沉淀质量之前需要进行的实验操作名称是
(5)若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值
您最近一年使用:0次
名校
解题方法
4 . 工业上,处理低品位黄铜矿[二硫化亚铁铜(CuFeS2)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(FeSO4∙7H2O)和胆矾(CuSO4∙5H2O)。相关流程如下图。
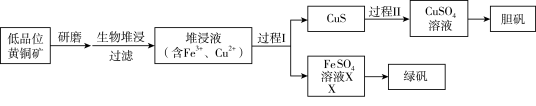
已知:①溶液中的c(H+)越大,pH越小,酸性越强。
②生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
③溶液中pH很小时,金属通常以离子形式存在,随着pH增大,有些离子会形成氢氧化物沉淀(即使pH<7也可沉淀),不同离子形成沉淀时的pH如下表所示。
(1)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段是在T。f细菌作用下,将黄铜矿溶解,第二阶段为Fe2+继续被氧化转变成Fe3+。
①补全第一阶段反应的离子方程式(反应物已配平):_______ 。CuFeS2+4H++O2 =_______。
=_______。
②写出第二阶段反应的离子方程式:_______ 。
(2)结合已知推断:生物堆浸过程中,应控制溶液的pH在_______ 范围内。
(3)已知:CuS是一种难溶于水的黑色固体。过程II中,用H2O2和稀硫酸处理后,CuS完全溶解 ,用离子方程式表示H2O2的作用是_______ 。
(4)绿矾的纯度可通过其与KMnO4反应测定。取mg绿矾晶体,加适量稀硫酸溶解,与物质的量浓度为cmol/L的KMnO4溶液恰好反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的计算式为_______ 。(已知:FeSO4·7H2O摩尔质量为278g/mol)

已知:①溶液中的c(H+)越大,pH越小,酸性越强。
②生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
③溶液中pH很小时,金属通常以离子形式存在,随着pH增大,有些离子会形成氢氧化物沉淀(即使pH<7也可沉淀),不同离子形成沉淀时的pH如下表所示。
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
①补全第一阶段反应的离子方程式(反应物已配平):
 =_______。
=_______。②写出第二阶段反应的离子方程式:
(2)结合已知推断:生物堆浸过程中,应控制溶液的pH在
(3)已知:CuS是一种难溶于水的黑色固体。过程II中,用H2O2和稀硫酸处理后,CuS
(4)绿矾的纯度可通过其与KMnO4反应测定。取mg绿矾晶体,加适量稀硫酸溶解,与物质的量浓度为cmol/L的KMnO4溶液恰好反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的计算式为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
5 . 胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的
)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为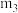 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为___________ (写表达式)。
(2)下列操作中,会导致结晶水数目测定值偏高的是___________ (填标号)。
①胆矾未充分干燥②坩埚未置于干燥器中冷却③加热时有少量胆矾迸溅出来
 )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的
)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)结晶水测定:称量干燥坩埚的质量为
 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为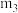 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为(2)下列操作中,会导致结晶水数目测定值偏高的是
①胆矾未充分干燥②坩埚未置于干燥器中冷却③加热时有少量胆矾迸溅出来
您最近一年使用:0次
名校
解题方法
6 . 从烟气脱硝催化剂(含 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。
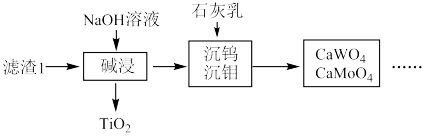
(1)粉碎的目的是_______ ,滤渣1的成分为_______ 。
(2)若酸浸还原产物为 ,其中V的化合价是
,其中V的化合价是_______ 。用 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式_______ 。
(3)写出“富集氧化”过程的化学方程式_______ ,若用 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
_______ mol。
(4)可用 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为_______ %。(保留1位小数)
(5) 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。________ 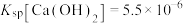 ,
,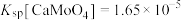 ,且
,且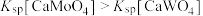 。
。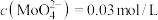 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为_______ 时开始产生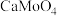 沉淀。
沉淀。
 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。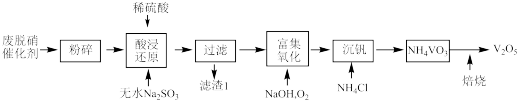
(1)粉碎的目的是
(2)若酸浸还原产物为
 ,其中V的化合价是
,其中V的化合价是 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式(3)写出“富集氧化”过程的化学方程式
 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
(4)可用
 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为(5)
 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。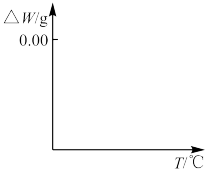
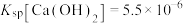 ,
,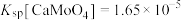 ,且
,且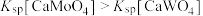 。
。
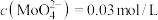 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为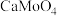 沉淀。
沉淀。
您最近一年使用:0次
2023-02-24更新
|
820次组卷
|
4卷引用:第8讲 物质的量与气体摩尔体积
7 . 碳酸锰( )用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为
)用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 ,过程如下(部分操作和条件略)。已知:
,过程如下(部分操作和条件略)。已知: 不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;
不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;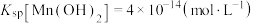 。回答下列问题:
。回答下列问题:
(1)制备 溶液:m g软锰矿粉经除杂后制得
溶液:m g软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如下图所示(夹持和加热装置略)。
溶液,实验装置如下图所示(夹持和加热装置略)。
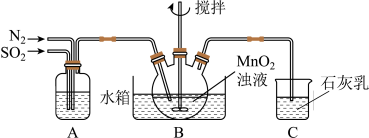
通过装置A可观察通入 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是_______ ;为使 尽可能转化完全,在停止实验前应进行的操作是
尽可能转化完全,在停止实验前应进行的操作是_______ ; 转化为
转化为 的离子方程式为
的离子方程式为_______ 。实验中若将 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是_______ 。
(2)制备 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到
溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到 固体。若用同浓度的
固体。若用同浓度的 溶液代替
溶液代替 溶液,将导致制得的
溶液,将导致制得的 产品中混有
产品中混有_______ (填化学式);用乙醇洗涤的目的是_______ 。
(3)测定软锰矿中锰元素的含量:向产品中加入稍过量的磷酸和硝酸,加热使 完全转化为
完全转化为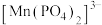 (其中
(其中 完全转化为
完全转化为 ),除去多余的硝酸,加入稍过量的硫酸铵除去
),除去多余的硝酸,加入稍过量的硫酸铵除去 ,加入稀硫酸酸化,再用
,加入稀硫酸酸化,再用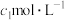 硫酸亚铁铵标准溶液滴定,发生反应
硫酸亚铁铵标准溶液滴定,发生反应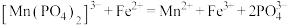 ,消耗标准液的体积平均为
,消耗标准液的体积平均为 mL;用
mL;用 mL
mL 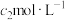 酸性
酸性 溶液恰好除去过量的
溶液恰好除去过量的 。软锰矿中锰元素的质量分数为
。软锰矿中锰元素的质量分数为_______ (用m,c,V的式子表示);用硫酸亚铁铵标准溶液滴定时,下列操作会使锰元素的质量分数偏大的是_______ (填标号)。
A.滴定管水洗后直接装入标准液 B.滴定终点时俯视滴定管读数
C.滴定管在滴定前有气泡,滴定后无气泡 D.锥形瓶未干燥即盛放待测液
 )用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为
)用途广泛,可用作脱硫的催化剂,涂料和饲料添加剂等。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 ,过程如下(部分操作和条件略)。已知:
,过程如下(部分操作和条件略)。已知: 不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;
不溶于水和乙醇,在干燥空气中稳定,潮湿时易被氧化;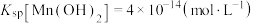 。回答下列问题:
。回答下列问题:(1)制备
 溶液:m g软锰矿粉经除杂后制得
溶液:m g软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如下图所示(夹持和加热装置略)。
溶液,实验装置如下图所示(夹持和加热装置略)。
通过装置A可观察通入
 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是 尽可能转化完全,在停止实验前应进行的操作是
尽可能转化完全,在停止实验前应进行的操作是 转化为
转化为 的离子方程式为
的离子方程式为 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 浓度,原因是
浓度,原因是(2)制备
 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到
溶液,过滤,分别用蒸馏水和乙醇洗涤,低于100℃干燥,得到 固体。若用同浓度的
固体。若用同浓度的 溶液代替
溶液代替 溶液,将导致制得的
溶液,将导致制得的 产品中混有
产品中混有(3)测定软锰矿中锰元素的含量:向产品中加入稍过量的磷酸和硝酸,加热使
 完全转化为
完全转化为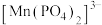 (其中
(其中 完全转化为
完全转化为 ),除去多余的硝酸,加入稍过量的硫酸铵除去
),除去多余的硝酸,加入稍过量的硫酸铵除去 ,加入稀硫酸酸化,再用
,加入稀硫酸酸化,再用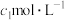 硫酸亚铁铵标准溶液滴定,发生反应
硫酸亚铁铵标准溶液滴定,发生反应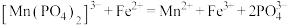 ,消耗标准液的体积平均为
,消耗标准液的体积平均为 mL;用
mL;用 mL
mL 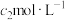 酸性
酸性 溶液恰好除去过量的
溶液恰好除去过量的 。软锰矿中锰元素的质量分数为
。软锰矿中锰元素的质量分数为A.滴定管水洗后直接装入标准液 B.滴定终点时俯视滴定管读数
C.滴定管在滴定前有气泡,滴定后无气泡 D.锥形瓶未干燥即盛放待测液
您最近一年使用:0次
8 . 某同学在实验室采用如图所示装置探究CO和 的反应,并检验部分产物。已知草酸(
的反应,并检验部分产物。已知草酸( )在浓硫酸存在时加热分解为
)在浓硫酸存在时加热分解为 、CO和
、CO和 ,装置E中的ZnO/CuO仅作催化剂,实验完毕,装置F中收集到纯净液体1.536 g,装置G中收集到的气体体积为89.6 mL(已折算成标准状况,不包括通入的氦气)。请回答下列问题:
,装置E中的ZnO/CuO仅作催化剂,实验完毕,装置F中收集到纯净液体1.536 g,装置G中收集到的气体体积为89.6 mL(已折算成标准状况,不包括通入的氦气)。请回答下列问题:
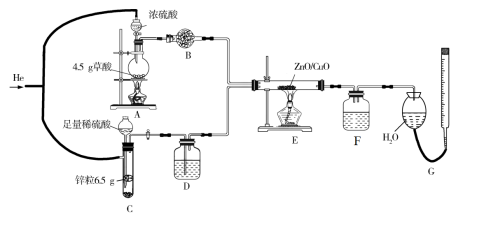
(1)装置B中盛放的试剂为_______ 。
(2)装置C中发生反应的离子方程式为_______ 。
(3)该实验中分两次通入氦气,第二次通入氦气的作用是_______ 。
(4)下列有关装置G的操作叙述正确的是_______ (填标号,后同)。
A.添加药品完毕,立即调整装置G中两液面相平,记录量气管的初始读数
B.当装置G中两液面差不再变化时,立即调整装置G中两液面相平,记录量气管的最终读数
C.初始读数时仰视,最终读数时俯视,导致测得气体体积偏大
(5)下列有关酒精灯操作的叙述正确的是_______。
(6)向装置F中的液体中投入金属钠,有气泡产生,通过其他实验测得装置F中液体为纯净物,且其相对分子质量为32,则装置E中反应的化学方程式为_______ 。
(7)综合实验中的数据,反应完毕,剩余
_______ mol。
 的反应,并检验部分产物。已知草酸(
的反应,并检验部分产物。已知草酸( )在浓硫酸存在时加热分解为
)在浓硫酸存在时加热分解为 、CO和
、CO和 ,装置E中的ZnO/CuO仅作催化剂,实验完毕,装置F中收集到纯净液体1.536 g,装置G中收集到的气体体积为89.6 mL(已折算成标准状况,不包括通入的氦气)。请回答下列问题:
,装置E中的ZnO/CuO仅作催化剂,实验完毕,装置F中收集到纯净液体1.536 g,装置G中收集到的气体体积为89.6 mL(已折算成标准状况,不包括通入的氦气)。请回答下列问题:
(1)装置B中盛放的试剂为
(2)装置C中发生反应的离子方程式为
(3)该实验中分两次通入氦气,第二次通入氦气的作用是
(4)下列有关装置G的操作叙述正确的是
A.添加药品完毕,立即调整装置G中两液面相平,记录量气管的初始读数
B.当装置G中两液面差不再变化时,立即调整装置G中两液面相平,记录量气管的最终读数
C.初始读数时仰视,最终读数时俯视,导致测得气体体积偏大
(5)下列有关酒精灯操作的叙述正确的是_______。
| A.先点燃装置A处酒精灯,后点燃装置E处酒精灯 |
| B.先点燃装置E处酒精灯,后点燃装置A处酒精灯 |
| C.先撤装置A处酒精灯,后撤装置E处酒精灯 |
| D.先撤装置E处酒精灯,后撤装置A处酒精灯 |
(7)综合实验中的数据,反应完毕,剩余

您最近一年使用:0次
9 . 为测定未知 溶液的浓度,某同学设计了如图所示装置(夹持装置略去),实验步骤如下:
溶液的浓度,某同学设计了如图所示装置(夹持装置略去),实验步骤如下:
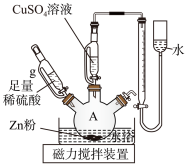
步骤1:组装仪器,并检查装置气密性;
步骤2:将x g Zn粉装入仪器A中,将足量稀硫酸和y mL 溶液分别装入两个恒压滴液漏斗中,并在最右侧容器内装入水,调整液面相平并记下量气管刻度a mL;
溶液分别装入两个恒压滴液漏斗中,并在最右侧容器内装入水,调整液面相平并记下量气管刻度a mL;
步骤3:将 溶液逐滴滴入仪器A中并搅拌,充分反应后,滴加稀硫酸至不再有气体产生;
溶液逐滴滴入仪器A中并搅拌,充分反应后,滴加稀硫酸至不再有气体产生;
步骤4:恢复至室温,调整液面相平并记下量气管刻度b mL。
回答下列问题:
(1)仪器A的名称是_______ 。
(2)导管g的作用是_______ 、_______ 。
(3)步骤4中若未恢复至室温,则测量得到的气体体积_______ (填“偏大”“偏小”或“无影响”)。
(4)实验温度下,气体摩尔体积为 mL·mol
mL·mol ,则
,则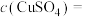
_______ mol·L (列出计算表达式),下列操作使
(列出计算表达式),下列操作使 溶液的浓度偏大的是
溶液的浓度偏大的是_______ (填标号)。
A.步骤1中未检验装置气密性,装置漏气
B.步骤2中俯视读数
C.步骤3中稀硫酸加入过多
D.步骤4中未调节液面相平
(5)测定未知 溶液的浓度也可用沉淀法:取p mL
溶液的浓度也可用沉淀法:取p mL  溶液于试管中,加入NaOH溶液至不再产生沉淀,过滤,洗涤沉淀并干燥至恒重,称量固体质量为q g,则
溶液于试管中,加入NaOH溶液至不再产生沉淀,过滤,洗涤沉淀并干燥至恒重,称量固体质量为q g,则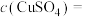
_______ mol·L (列出计算表达式)。
(列出计算表达式)。
 溶液的浓度,某同学设计了如图所示装置(夹持装置略去),实验步骤如下:
溶液的浓度,某同学设计了如图所示装置(夹持装置略去),实验步骤如下:
步骤1:组装仪器,并检查装置气密性;
步骤2:将x g Zn粉装入仪器A中,将足量稀硫酸和y mL
 溶液分别装入两个恒压滴液漏斗中,并在最右侧容器内装入水,调整液面相平并记下量气管刻度a mL;
溶液分别装入两个恒压滴液漏斗中,并在最右侧容器内装入水,调整液面相平并记下量气管刻度a mL;步骤3:将
 溶液逐滴滴入仪器A中并搅拌,充分反应后,滴加稀硫酸至不再有气体产生;
溶液逐滴滴入仪器A中并搅拌,充分反应后,滴加稀硫酸至不再有气体产生;步骤4:恢复至室温,调整液面相平并记下量气管刻度b mL。
回答下列问题:
(1)仪器A的名称是
(2)导管g的作用是
(3)步骤4中若未恢复至室温,则测量得到的气体体积
(4)实验温度下,气体摩尔体积为
 mL·mol
mL·mol ,则
,则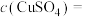
 (列出计算表达式),下列操作使
(列出计算表达式),下列操作使 溶液的浓度偏大的是
溶液的浓度偏大的是A.步骤1中未检验装置气密性,装置漏气
B.步骤2中俯视读数
C.步骤3中稀硫酸加入过多
D.步骤4中未调节液面相平
(5)测定未知
 溶液的浓度也可用沉淀法:取p mL
溶液的浓度也可用沉淀法:取p mL  溶液于试管中,加入NaOH溶液至不再产生沉淀,过滤,洗涤沉淀并干燥至恒重,称量固体质量为q g,则
溶液于试管中,加入NaOH溶液至不再产生沉淀,过滤,洗涤沉淀并干燥至恒重,称量固体质量为q g,则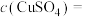
 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
名校
10 . 明矾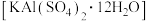 可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。
可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。
Ⅰ.制备明矾
实验步骤如图:
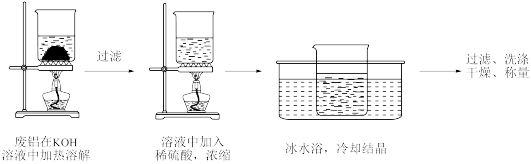
(1)溶解步骤中主要发生的离子反应方程式为_______ 。
(2)用蒸馏水洗涤晶体的操作过程是_______ 。
(3)生活中明矾可用作净水剂,结合离子方程式说明净水原理:_______ 。
Ⅱ.样品中硫酸根的测定
(一)绘制标准硫酸钡悬浊液吸光光谱图
①分别量取0、1.0、2.0、3.0、4.0mL浓度为500μg/mL的标准硫酸钾溶液移入10mL的比色管中,然后分别加入5mL浓度为1g/mL的 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。
②用分光光度计测量标准系列(波长采用420nm),数据如下(忽略混合过程中的体积变化)。
③绘制硫酸钡悬浊液的吸光光谱图,绘制如下。
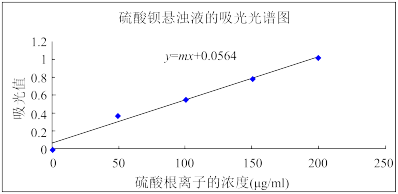
(4)上述实验数据中b=_______ ,m=_______ (保留1位有效数字)。
(二)测定样品中硫酸根浓度
①称取1.018g样品晶体配制成250mL的样品溶液。
②量取1.0mL样品溶液移入10mL的比色管中,然后加入5mL浓度为1g/mL的 溶液,用蒸馏水定容,测得样品的吸光值为0.858。
溶液,用蒸馏水定容,测得样品的吸光值为0.858。
(5)测得样品中硫酸根的质量分数为_______ %(保留2位有效数字)。
(6)实验测得硫酸根的含量小于理论值,可能的原因有_______(填标号)。
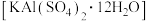 可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。
可做中药,性味酸涩、寒、有毒。利用废铝制备明矾,并测定其组成,实验过程如下。Ⅰ.制备明矾
实验步骤如图:

(1)溶解步骤中主要发生的离子反应方程式为
(2)用蒸馏水洗涤晶体的操作过程是
(3)生活中明矾可用作净水剂,结合离子方程式说明净水原理:
Ⅱ.样品中硫酸根的测定
(一)绘制标准硫酸钡悬浊液吸光光谱图
①分别量取0、1.0、2.0、3.0、4.0mL浓度为500μg/mL的标准硫酸钾溶液移入10mL的比色管中,然后分别加入5mL浓度为1g/mL的
 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。②用分光光度计测量标准系列(波长采用420nm),数据如下(忽略混合过程中的体积变化)。
 (mL) (mL) | 1.0 | 2.0 | 3.0 | 4.0 | |
| 蒸馏水体积(mL) | 5 | a | b | c | 1 |
 浓度(μg/mL) 浓度(μg/mL) | 0 | 50 | 100 | 150 | 200 |
| 吸光值A | 0 | 0.371 | 0.553 | 0.778 | 1.013 |

(4)上述实验数据中b=
(二)测定样品中硫酸根浓度
①称取1.018g样品晶体配制成250mL的样品溶液。
②量取1.0mL样品溶液移入10mL的比色管中,然后加入5mL浓度为1g/mL的
 溶液,用蒸馏水定容,测得样品的吸光值为0.858。
溶液,用蒸馏水定容,测得样品的吸光值为0.858。(5)测得样品中硫酸根的质量分数为
(6)实验测得硫酸根的含量小于理论值,可能的原因有_______(填标号)。
A.实验Ⅰ制得样品中有 杂质 杂质 | B.实验中所用标准硫酸钾溶液浓度偏大 |
| C.样品溶液配制过程中,定容仰视读数 | D.样品溶液配制过程中,容量瓶未润洗 |
您最近一年使用:0次



