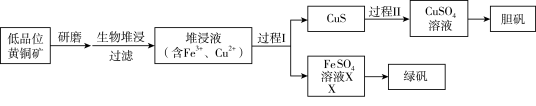
已知:①溶液中的c(H+)越大,pH越小,酸性越强。
②生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
③溶液中pH很小时,金属通常以离子形式存在,随着pH增大,有些离子会形成氢氧化物沉淀(即使pH<7也可沉淀),不同离子形成沉淀时的pH如下表所示。
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
①补全第一阶段反应的离子方程式(反应物已配平):
 =_______。
=_______。②写出第二阶段反应的离子方程式:
(2)结合已知推断:生物堆浸过程中,应控制溶液的pH在
(3)已知:CuS是一种难溶于水的黑色固体。过程II中,用H2O2和稀硫酸处理后,CuS
(4)绿矾的纯度可通过其与KMnO4反应测定。取mg绿矾晶体,加适量稀硫酸溶解,与物质的量浓度为cmol/L的KMnO4溶液恰好反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的计算式为
相似题推荐
【推荐1】某化学实验兴趣小组欲配制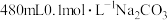 溶液,但是他们在实验室仅发现一瓶标签已部分缺失的纯碱固体(
溶液,但是他们在实验室仅发现一瓶标签已部分缺失的纯碱固体(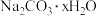 )。
)。
Ⅰ.同学 提出“寻找标签”方案:取
提出“寻找标签”方案:取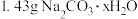 溶于水,配成
溶于水,配成 溶液。然后向其中逐滴滴入稀盐酸直至没有气体放出,共用去盐酸
溶液。然后向其中逐滴滴入稀盐酸直至没有气体放出,共用去盐酸 ,并收集到
,并收集到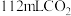 (标准状况下)。请你帮忙计算:
(标准状况下)。请你帮忙计算:
(1)稀盐酸的物质的量浓度为 。
。
(2) 的值为
的值为
Ⅱ.小组同学开始配制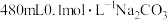 溶液:
溶液:
(3)在配制过程中,同学们应使用的玻璃仪器除烧杯、胶头滴管、量筒、玻璃棒外,还需要
(4)在配制过程中,同学们的下列操作中错误的有:
A.容量瓶用蒸馏水洗净后,不经干燥直接用来配制溶液
B.在托盘天平上放两张大小、质量一样的纸,然后把纯碱固体放在右边托盘上称量
C.用蒸馏水洗涤烧杯内壁及玻璃棒2-3次,洗涤液都移入容量瓶中
D.定容时,液面不小心超过了容量瓶的刻度线,用胶头滴管吸出超出的一部分
(5)实验后,同学们对配制过程进行评价与反思:
①定容时视线应与凹液面最低点相平,若俯视刻度线观察液面,则会导致配制的溶液浓度
②摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线,则会导致配制的溶液浓度
 (熔点:
(熔点: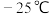 ,沸点:136℃)是制备海绵钛和钛白的主要原料,易水解生成
,沸点:136℃)是制备海绵钛和钛白的主要原料,易水解生成 。某同学利用如图装置制备
。某同学利用如图装置制备 并验证产物CO。
并验证产物CO。
回答下列问题:
(1)仪器X的名称为
(2)装置B中收集到的物质是
(3)能证明有CO生成的实验现象是
(4)下列装置可以代替装置F的是
a.
 b.
b.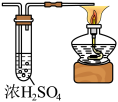
c.
 d.
d.
(5)产品中
 含量测定:
含量测定:取

 产品于烧瓶中,向安全漏斗中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗中液体及烧瓶中混合物全部转入锥形瓶中,滴加几滴指示剂,用
产品于烧瓶中,向安全漏斗中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗中液体及烧瓶中混合物全部转入锥形瓶中,滴加几滴指示剂,用 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液VmL。
溶液VmL。
①
 与
与 反应的化学方程式为
反应的化学方程式为②安全漏斗中的水在本实验中的作用除液封、作反应物外,还能
③该产品的纯度为

(1)在结晶过程中,pH、温度对硫酸亚铁纯度的影响如图1、图2,则蒸发结晶时适宜的条件为
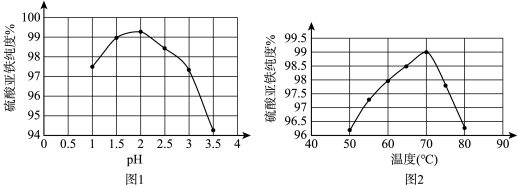
(2)离心分离后在30℃下干燥6h后得高纯度硫酸亚铁晶体,30℃下干燥其原因可能是
(3)实验室进行过滤操作时所需用到的玻璃仪器有
(4)硫酸亚铁晶体可用来净化硫酸亚铁晶体可用来净化含K2Cr2O7废水,取一定质量的FeSO4·7H2O 和足量的KOH溶液加入到含K2Cr2O7废水中可得到一定量的磁性材料Cr0.5Fe1.5FeO4,处理含5.00×10-3mol K2Cr2O7的废水,需要多少克的FeSO4·7H2O(写出计算过程)。

(1)装置A的目的是利用生成的
 将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为
将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为(2)B装置中稀硝酸发生反应主要表现出的化学性质有
(3)为实现装置C的作用,应采用的操作和观察到的现象为
(4)将28.8g铜与140mL一定浓度的硝酸反应,铜完全溶解。产生的NO和
 混合气体在标准状况下的体积为11.2L,其中NO的体积为
混合气体在标准状况下的体积为11.2L,其中NO的体积为
(1)以上步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是
(2)流程II中将吹出的溴蒸气用纯碱溶液吸收时还有
 生成,写出吸收时发生反应的离子方程式:
生成,写出吸收时发生反应的离子方程式:(3)实验室分离溴水中的溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是_______。(填序号)
| A.四氯化碳 | B.乙醇 | C.烧碱溶液 | D.苯 |
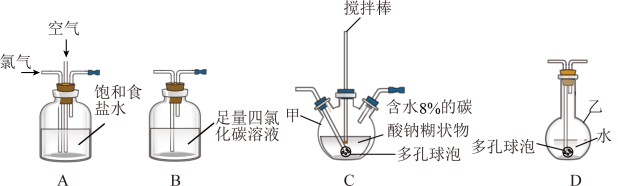
(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为
(2)装置C中的仪器甲的名称为
(3)装置B的作用为
(4)测定装置D中得到的次氯酸的物质的量浓度。量取20mL装置D中得到的次氯酸溶液,并稀释至100mL,再从中取出20.00mL至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,滴加0.5mol•L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00mL(反应为2Na2S2O3+I2=Na2S4O6+2NaI)。
①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为
②恰好反应时的现象为
③装置D中得到的次氯酸的物质的量浓度为
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有
______ MnO
 + ______ H2C2O4 + ______ H+ =______ Mn2+ + ______ CO2↑ + ______ H2O
+ ______ H2C2O4 + ______ H+ =______ Mn2+ + ______ CO2↑ + ______ H2O(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):
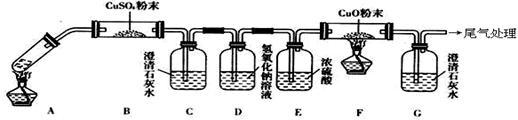
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红色。据此回答:
①上述装置中,D的作用是
②乙二酸分解的化学方程式为
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化)。则下列关系合理的是
A.c(Na+)+c(H+)=c(HC2O
 )+c(OH—)+c(C2O
)+c(OH—)+c(C2O )
) B.c(HC2O
 )+c(C2O
)+c(C2O )=0.2mol·L-1
)=0.2mol·L-1C. c(HC2O
 )>c(C2O
)>c(C2O )>c(H2C2O4)
)>c(H2C2O4)D.c(Na+)=c(H2C2O4)+c(HC2O
 )+c(C2O
)+c(C2O )
)
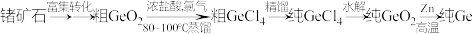
已知部分物质的沸点
 1200℃、
1200℃、 83℃、
83℃、 130℃。回答下列问题:
130℃。回答下列问题:(1)Ge是第
(2)粗
 中常含有少量的
中常含有少量的 ,为除去它,可加入足量浓盐酸,并通入大量的氯气,物质转化关系为
,为除去它,可加入足量浓盐酸,并通入大量的氯气,物质转化关系为 ,欲处理含1moL
,欲处理含1moL 的矿物,理论上需要氯气的体积为
的矿物,理论上需要氯气的体积为(3)蒸馏时温度要控制在83~100℃,温度不宜过高的主要原因是:①避免粗
 中含有过多的杂质,②
中含有过多的杂质,②(4)
 的电子式是
的电子式是 的化学方程式是
的化学方程式是(5)实验室进行蒸馏操作时,需要用到下列仪器中的
a.
 b.
b.
c.
 d.
d.
已知:①SrSO4微溶于水;
②SrCl2•6H2O在61.5℃以上即会失去4个结晶水生成SrCl2•2H2O。
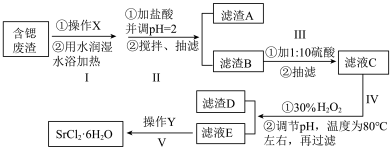
(1)关于上述实验操作下列说法不正确的是
A.步骤I中操作X为研磨粉碎,可以增大反应接触面积
B.步骤III为提高产率,可以用滤液淋洗布氏漏斗中的滤渣
C.抽滤时,如果溶液有强酸性,可以用玻璃纤维代替滤纸
D.减压过滤不宜过滤胶状沉淀,因为胶状沉淀会在滤纸上形成一层密实的沉淀
E.步骤IV中的温度控制在80℃左右,可以用水浴加热,也可以用油浴或砂浴加热代替,更安全
(2)下表为实验中硫酸加入量对溶液中Ba2+和Sr2+含量的影响,实验发现在步骤III中加入硫酸量过量20%较合适,请解释原因:
| 硫酸加入量/mL | 4.50 | 4.95 | 5.40 | 5.85 | 6.30 |
| Ba2+/(g/L) | 0.37 | 0.21 | 0.13 | 0.11 | 0.10 |
| Sr2+/(g/L) | 90.21 | 89.86 | 89.57 | 89.23 | 88.90 |
(3)①步骤IV调节pH时,为避免引入新的杂质,最适宜加入的试剂为

②往滤渣D中加入NaClO溶液,发生反应的离子方程式为:
(4)在步骤V中,若要从滤液E通过操作Y得到大颗粒的高纯六水氯化锶晶体,操作Y包含下列步骤中的某几项,请选择合适的操作并排序。(填相应步骤的字母)
滤液E→
a.蒸发浓缩至有大量晶体析出
b.在过饱和溶液中加入晶种
c.6l.5℃以上减压蒸发浓缩
d.6l.5℃以下减压蒸发浓缩
e.往溶液中加入无水乙醇
f.在30℃真空烘箱中干燥
g.在室温下缓慢冷却结晶
h.用氯化锶饱和溶液洗涤晶体
I.用冷水洗涤晶体
(5)为侧定所制SrCl2•6H2O晶体的纯度,取1.12g实验制得的产物加水溶解,配成100mL溶液,用移液管取出25mL于锥形瓶中,滴入几滴K2CrO4,已知Ag2CrO4为砖红色沉淀,用浓度为0.100mol/L的硝酸银标准溶液滴定。
①判断滴定终点的现象为
②实验时未采用棕色滴定管滴定,会使测得的晶体纯度



