1 . 固体化合物X由4种元素组成,其中2种为短周期元素,某学习小组开展如下探究实验:
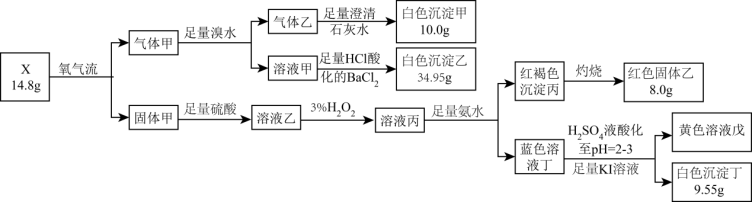
请回答:
(1)组成X的元素有_______ ,X的化学式为_______ 。
(2)溶液丙中含有的溶质除 外还有
外还有_______ ,相同条件下对应阳离子的氧化性由强到弱的排序为_______ 。
(3)溶液丁到沉淀丁的离子方程式是_______ 。
(4)已知白色沉淀丁几乎不溶于水和乙醇,溶于盐酸且该过程中铜元素化合价没有变化,请设计实验验证白色沉淀丁的组成元素_______ 。

请回答:
(1)组成X的元素有
(2)溶液丙中含有的溶质除
 外还有
外还有(3)溶液丁到沉淀丁的离子方程式是
(4)已知白色沉淀丁几乎不溶于水和乙醇,溶于盐酸且该过程中铜元素化合价没有变化,请设计实验验证白色沉淀丁的组成元素
您最近一年使用:0次
2 . 化合物X是由四种短周期元素组成的盐,不带结晶水,某兴趣小组按如下流程对其进行探究实验。已知化合物X的焰色反应呈黄色。
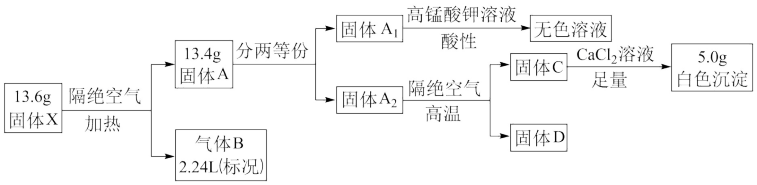
请回答:
(1)化合物X的组成元素为_______ (填元素符号)和Na,气体D的化学式为________ 。
(2)写出确定气体B的依据:_______ 。
(3)上述流程中固体 生成无色溶液的离子方程式为
生成无色溶液的离子方程式为______ 。
(4)已知固体X在高温下可将CuO还原成Cu,写出该反应方程式______ 。取足量固体X与WgCuO(设CuO完全反应)共热,请设计实验证明还原产物的组成______ 。
(提示:CuO的还原产物可能为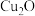 ,
,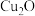 在酸性条件下不稳定,发生反应为
在酸性条件下不稳定,发生反应为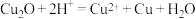 )
)

请回答:
(1)化合物X的组成元素为
(2)写出确定气体B的依据:
(3)上述流程中固体
 生成无色溶液的离子方程式为
生成无色溶液的离子方程式为(4)已知固体X在高温下可将CuO还原成Cu,写出该反应方程式
(提示:CuO的还原产物可能为
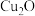 ,
,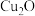 在酸性条件下不稳定,发生反应为
在酸性条件下不稳定,发生反应为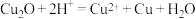 )
)
您最近一年使用:0次
2022-02-22更新
|
708次组卷
|
4卷引用:回归教材重难点02 常见无机物转化及应用-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)
(已下线)回归教材重难点02 常见无机物转化及应用-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点02 常见无机物转化及应用-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)浙江省浙南名校联考2021-2022学年下学期高三返校联考化学试题浙江省浙南联盟2022届高三第二次模拟考试化学试题
2022高三·全国·专题练习
解题方法
3 . 高铁酸钾(K2FeO4)为紫黑色固体,易溶于水,微溶于KOH浓溶液,是一种高效净水剂。一种制备K2FeO4的方法为Cl2与KOH溶液反应生成KClO(在较高温度下生成KClO3),KClO、Fe(OH)3与KOH溶液反应制得K2FeO4.实验装置如图所示:
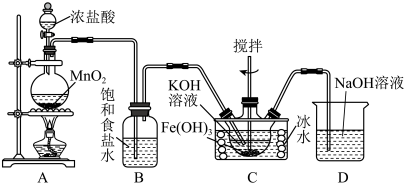
实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.1500gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用0.1000 的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00mL。滴定时,发生反应的离子方程式:
的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00mL。滴定时,发生反应的离子方程式: ;
;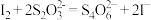 。请计算K2FeO4样品的纯度:
。请计算K2FeO4样品的纯度:_______ (写出计算过程)。

实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.1500gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用0.1000
 的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00mL。滴定时,发生反应的离子方程式:
的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00mL。滴定时,发生反应的离子方程式: ;
;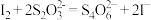 。请计算K2FeO4样品的纯度:
。请计算K2FeO4样品的纯度:
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
4 . 测定氮化钙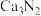 的纯度:
的纯度:
(1)甲同学称取 反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得
反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得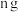 沉淀,通过数据
沉淀,通过数据 、
、 即可求得氮化钙的质量分数。甲同学的方案是否合理?
即可求得氮化钙的质量分数。甲同学的方案是否合理?_______ (填“是”或“否”),理由是_______ 。
(2)乙同学的方案如下:取氮化钙样品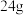 ,按图所示装置进行实验,发现
,按图所示装置进行实验,发现 装置增重
装置增重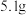 。
。

①该样品中氮化钙的质量分数为_______ 。
②导致该样品中氮化钙含量测定结果偏低的可能原因是_______ 。
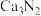 的纯度:
的纯度:(1)甲同学称取
 反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得
反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得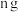 沉淀,通过数据
沉淀,通过数据 、
、 即可求得氮化钙的质量分数。甲同学的方案是否合理?
即可求得氮化钙的质量分数。甲同学的方案是否合理?(2)乙同学的方案如下:取氮化钙样品
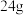 ,按图所示装置进行实验,发现
,按图所示装置进行实验,发现 装置增重
装置增重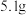 。
。
①该样品中氮化钙的质量分数为
②导致该样品中氮化钙含量测定结果偏低的可能原因是
您最近一年使用:0次
名校
5 . 高铁酸钾(K2FeO4)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。某兴趣小组设计如下实验制备K2FeO4并探究其性质。
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
② 具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
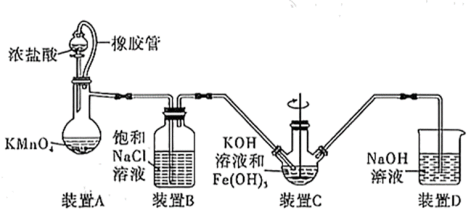
(1)制备K2FeO4(夹持装置略)
①如图所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是_______ 。
②装置B的作用是_______ 。
③装置C中的KOH溶液需过量,目的是________ 。
④C中得到紫色固体和溶液。则C中Cl2与Fe(OH)3发生反应生成K2FeO4的离子方程式为______
(2)探究K2FeO4的性质甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该现象______ (填“能”或“不能”)证明“酸性条件下 氧化性强于Cl2”,并说明理由:
氧化性强于Cl2”,并说明理由:______ 。
(3)测定K2FeO4的产率若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为________ 。
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
②
 具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
①如图所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是
②装置B的作用是
③装置C中的KOH溶液需过量,目的是
④C中得到紫色固体和溶液。则C中Cl2与Fe(OH)3发生反应生成K2FeO4的离子方程式为
(2)探究K2FeO4的性质甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该现象
 氧化性强于Cl2”,并说明理由:
氧化性强于Cl2”,并说明理由:(3)测定K2FeO4的产率若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为
您最近一年使用:0次
2021-09-28更新
|
641次组卷
|
4卷引用:押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)
(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)江苏省海安市南莫中学2022届高三上学期第一次月考备考金卷B卷化学试题内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题
名校
6 . 将一定量的某铁的氧化物加入到100mL 5mol/L的盐酸中恰好完全反应,现将等量的该铁的氧化物加入到足量的某浓度的硝酸中使之完全反应,生成气态氮氧化物,将气态氮氧化物和标准状况下0.56L O2混合通入水中,气体恰好完全被水吸收。
(1)若用质量分数为36.5%,密度为1.2g/cm3的浓盐酸配制100mL 5mol/L的稀盐酸,需要浓盐酸___________ mL(保留小数点后1位)。
(2)求算该氧化物的化学式___________ (写出计算过程)。
(1)若用质量分数为36.5%,密度为1.2g/cm3的浓盐酸配制100mL 5mol/L的稀盐酸,需要浓盐酸
(2)求算该氧化物的化学式
您最近一年使用:0次
2021-09-04更新
|
255次组卷
|
3卷引用:解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省名校协作体(绍兴市第一中学等)2022届高三上学期期初联考化学试题浙江省温州市瑞安中学2021-2022学年高二下学期开学考试化学试题
2021高三·全国·专题练习
7 . 草酸钴是制备钴的氧化物的重要原料。如图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
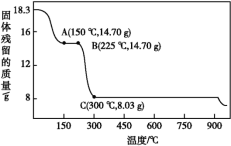
(1)通过计算确定C点剩余固体的化学成分为___________ (填化学式);试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:___________ 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480mL5mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。试确定该钴氧化物的化学式为___________ 。

(1)通过计算确定C点剩余固体的化学成分为
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480mL5mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。试确定该钴氧化物的化学式为
您最近一年使用:0次
20-21高一上·江苏镇江·期中
解题方法
8 . 实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
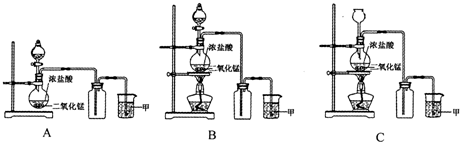
(1)A、B、C三套装置中,应选用的装置是___________ (选填“A”、“B”、“C);
(2)写出实验室制取的氯气与水反应的化学方程式___________ 。工业上常用氯气制备便于保存和运输的固体消毒剂漂白粉,请写出工业制取漂白粉的方程式___________ 。
(3)为了防止氯气污染环境,图中溶液甲中发生的化学反应方程式___________ 。
(4)工业上用电解熔融氯化钠制备金属钠和氯气。把表面已被氧化的金属钠5.84 g放入94.36 g水中,当反应完毕时,生成标准状况下的氢气2.24 L。
计算:①此金属钠表面氧化物的物质的量___________ ?
②所得溶液的溶质质量分数是多少___________ ?
③该溶液最多能吸收标准状况下氯气多少升___________ ? (不考虑氯气的溶解)(写出详细计算过程。)

(1)A、B、C三套装置中,应选用的装置是
(2)写出实验室制取的氯气与水反应的化学方程式
(3)为了防止氯气污染环境,图中溶液甲中发生的化学反应方程式
(4)工业上用电解熔融氯化钠制备金属钠和氯气。把表面已被氧化的金属钠5.84 g放入94.36 g水中,当反应完毕时,生成标准状况下的氢气2.24 L。
计算:①此金属钠表面氧化物的物质的量
②所得溶液的溶质质量分数是多少
③该溶液最多能吸收标准状况下氯气多少升
您最近一年使用:0次
9 . 三氯化氮(NCl3)是一种强氧化剂,工业上可用于漂白和消毒,实验室可由氯气通入碳酸铵溶液中制得。某化学小组利用此原理进行实验室制备三氯化氮。
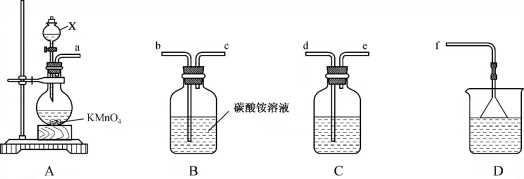
回答下列问题:
(1)装置A中仪器X的名称是_______ ,盛放的试剂是_______ ,装置A中发生反应的离子方程式为_______ 。
(2)整个装置的导管连接顺序为a→_______ →_______ →_______ →_______ →_______ 。
(3)装置B中发生反应的化学方程式为_______ 。
(4)装置C的作用为_______ 。装置D的作用为_______ 。
(5)三氯化氮浓度的测定:准确量取20mL装置B中反应后的溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀,吸取25.0mL于烧杯中,加入足量V1mLc1mol·L-1亚硫酸钠溶液,充分反应后,向烧杯中加入足量V2mLc2mol·L-1盐酸酸化的氯化钡溶液,得沉淀mg。
已知:i._______ Na2SO3+_______ NCl3 +_______=_______Na2SO4 +_______ HCl+ _______NH4Cl;
ii. BaCl2 +Na2SO4=BaSO↓+ 2HCl。
①请完成反应i的化学方程式:i._______ Na2SO3+_______ NCl3+_______=Na2SO4+_______ HCl+_______ NH4Cl
_______
②装置B反应后的溶液中三氯化氮的浓度为_______ mol·L-1。

回答下列问题:
(1)装置A中仪器X的名称是
(2)整个装置的导管连接顺序为a→
(3)装置B中发生反应的化学方程式为
(4)装置C的作用为
(5)三氯化氮浓度的测定:准确量取20mL装置B中反应后的溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀,吸取25.0mL于烧杯中,加入足量V1mLc1mol·L-1亚硫酸钠溶液,充分反应后,向烧杯中加入足量V2mLc2mol·L-1盐酸酸化的氯化钡溶液,得沉淀mg。
已知:i._______ Na2SO3+_______ NCl3 +_______=_______Na2SO4 +_______ HCl+ _______NH4Cl;
ii. BaCl2 +Na2SO4=BaSO↓+ 2HCl。
①请完成反应i的化学方程式:i._______ Na2SO3+_______ NCl3+_______=Na2SO4+_______ HCl+_______ NH4Cl
②装置B反应后的溶液中三氯化氮的浓度为
您最近一年使用:0次
2021-06-16更新
|
762次组卷
|
3卷引用:考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题
名校
解题方法
10 . 钌(Ru)粉主要用于生产钌靶材,而钌靶材是生产计算机硬盘不可替代的材料。以钌废料制备高纯钌粉的流程如下:
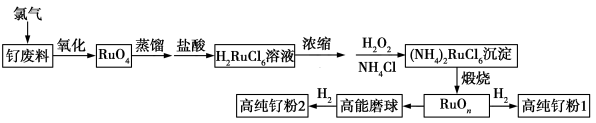
已知:含钌废料中钌主要以单质的形式存在,钌在碱性条件下被氯气“氧化”为RuO4,RuO4是有毒的挥发性物质,蒸馏,用盐酸吸收得到红色H2RuCl6溶液,其中还含有少量RuCl 。回答下列问题:
。回答下列问题:
(1)钌废料在碱性条件下被氯气“氧化”的离子方程式为_______ ;钌废料氧化时,随着温度的升高,钌的回收率变化如图所示。综合考虑,确定氧化时的温度以_______ ℃为宜。
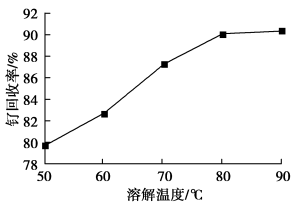
(2)用盐酸吸收蒸馏产物时发生氧化还原反应,生成一种可循环到“氧化”环节的气体,若标准状况下产生0.896L该气体,则消耗盐酸中HCl的物质的量为_______ 。(不考虑生成RuCl )
)
(3)“浓缩”步骤时用到的玻璃仪器有酒精灯、烧杯,还有_______ 。
(4)加入H2O2的主要作用是_______ ,同时又调节了溶液的pH,有利于沉淀反应的发生。
(5)煅烧的过程可以分为两步,第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物RuOn(n=1~3)。第1步的化学反应方程式为_______ 。

已知:含钌废料中钌主要以单质的形式存在,钌在碱性条件下被氯气“氧化”为RuO4,RuO4是有毒的挥发性物质,蒸馏,用盐酸吸收得到红色H2RuCl6溶液,其中还含有少量RuCl
 。回答下列问题:
。回答下列问题:(1)钌废料在碱性条件下被氯气“氧化”的离子方程式为

(2)用盐酸吸收蒸馏产物时发生氧化还原反应,生成一种可循环到“氧化”环节的气体,若标准状况下产生0.896L该气体,则消耗盐酸中HCl的物质的量为
 )
)(3)“浓缩”步骤时用到的玻璃仪器有酒精灯、烧杯,还有
(4)加入H2O2的主要作用是
(5)煅烧的过程可以分为两步,第1步是氯钌酸铵分解生成钌单质和一种无毒的气体单质,同时有两种化合物生成;第2步是钌单质与氧气反应生成钌的氧化物RuOn(n=1~3)。第1步的化学反应方程式为
您最近一年使用:0次
2021-06-09更新
|
478次组卷
|
3卷引用:专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习
(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习湖南省长沙市明德中学2021届高三下学期第三次模拟考试化学试题湖南省邵阳邵东市第一中学2022届高三上学期第一次月考化学试题



