2021高三·全国·专题练习
解题方法
1 . 2020年12月17日,中国探月工程嫦娥五号任务取得圆满成功。嫦娥五号锂离子蓄电池选用了比能量更高的钴酸锂(LiCoO2)正极材料和石墨负极材料。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大,钴酸锂回收再生流程如图:
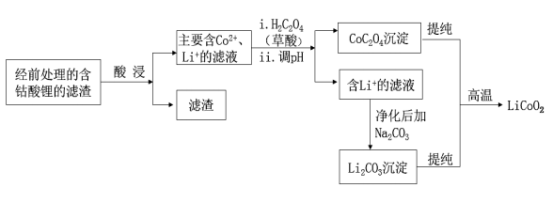
(1)已知常温下草酸Ka1=5.6×10-2,Ka2=1.5×10-4,Ksp(CoC2O4)=4.0×10-6,求常温下Co2+与草酸反应生成CoC2O4沉淀的平衡常数K=_______ 。
(2)高温下,在O2存在时,纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为_______ 。
(3)在空气中煅烧CoC2O4生成钴的氧化物和CO2,若测得充分煅烧后固体的质量为3.615g,CO2的体积为2.016L(标准状况),则钴的氧化物的化学式为_______ 。

(1)已知常温下草酸Ka1=5.6×10-2,Ka2=1.5×10-4,Ksp(CoC2O4)=4.0×10-6,求常温下Co2+与草酸反应生成CoC2O4沉淀的平衡常数K=
(2)高温下,在O2存在时,纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为
(3)在空气中煅烧CoC2O4生成钴的氧化物和CO2,若测得充分煅烧后固体的质量为3.615g,CO2的体积为2.016L(标准状况),则钴的氧化物的化学式为
您最近一年使用:0次
解题方法
2 . 过氧化钙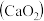 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。
Ⅰ.制备
利用反应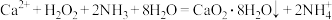 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
(1) 的电子式为
的电子式为_______ 。
(2)写出甲装置中反应的化学方程式_______ 。
(3)仪器A的名称为_______ ;仪器B的作用是_______ 。
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高 的产率和
的产率和_______ 。
(5)反应结束后,分离提纯 的过程中,洗涤的操作为
的过程中,洗涤的操作为_______ 。
Ⅱ.制得产品并定量检测
(6) 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有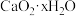 和
和 ,已知
,已知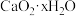 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取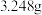 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀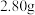 ,则该产品中
,则该产品中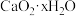 的x值为
的x值为_______ 。
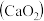 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。Ⅰ.制备

利用反应
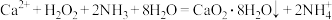 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
(1)
 的电子式为
的电子式为(2)写出甲装置中反应的化学方程式
(3)仪器A的名称为
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高
 的产率和
的产率和(5)反应结束后,分离提纯
 的过程中,洗涤的操作为
的过程中,洗涤的操作为Ⅱ.制得产品并定量检测
(6)
 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有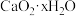 和
和 ,已知
,已知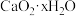 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取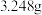 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀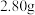 ,则该产品中
,则该产品中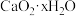 的x值为
的x值为
您最近一年使用:0次
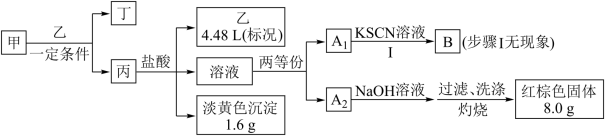
3 . 某小组对固体化合物甲开展探究实验。甲和气体乙以物质的量之比 恰好反应生成固体化合物丙和无色液体丁,甲和丙均由两种元素组成,实验中所加盐酸和NaOH溶液均足量。
恰好反应生成固体化合物丙和无色液体丁,甲和丙均由两种元素组成,实验中所加盐酸和NaOH溶液均足量。
请回答:
(1)组成甲的元素是___________ (填元素符号),甲的化学式是___________ 。
(2)甲与乙反应的化学方程式是___________ 。
(3)丙与盐酸反应的离子方程式是___________ 。
(4)向溶液B中滴加氯水至过量,溶液先变血红色最后褪去。褪色的原因是___________ ,请设计实验方案证明之___________ 。
 恰好反应生成固体化合物丙和无色液体丁,甲和丙均由两种元素组成,实验中所加盐酸和NaOH溶液均足量。
恰好反应生成固体化合物丙和无色液体丁,甲和丙均由两种元素组成,实验中所加盐酸和NaOH溶液均足量。
请回答:
(1)组成甲的元素是
(2)甲与乙反应的化学方程式是
(3)丙与盐酸反应的离子方程式是
(4)向溶液B中滴加氯水至过量,溶液先变血红色最后褪去。褪色的原因是
您最近一年使用:0次
解题方法
4 . 电子工业中,人们常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。某项目学习小组设计如下流程处理废液和资源回收:
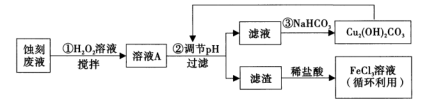
(1)FeCl3溶液中通常加入一定量的盐酸,其加入盐酸的目的是___________ ;将FeCl3溶液蒸干、灼烧后,得到的主要固体产物是___________ 。
(2)用足量FeCl3溶液蚀刻铜箔后的废液中含有的金属阳离子有___________ (填离子符号)。
(3)步骤①中加入H2O2溶液的目的是___________ 。 (用离子方程式表示)。
(4)已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是___________ 。
(5)步骤③中,由于NaHCO3部分水解生成Cu2(OH)2CO3沉淀和CO2气体,写出其反应的离子方程式___________ 。
(6)步骤③中生成的Cu2(OH)2CO3中会混有少量CuCO3取样品w g,测得n(Cu)=a mol, 则Cu2(OH)2CO3的纯度为___________ (用字母表示,列出表达式即可)。

(1)FeCl3溶液中通常加入一定量的盐酸,其加入盐酸的目的是
(2)用足量FeCl3溶液蚀刻铜箔后的废液中含有的金属阳离子有
(3)步骤①中加入H2O2溶液的目的是
(4)已知:生成氢氧化物沉淀的pH
| Cu( OH)2 | Fe(OH)2 | Fe( OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)步骤③中,由于NaHCO3部分水解生成Cu2(OH)2CO3沉淀和CO2气体,写出其反应的离子方程式
(6)步骤③中生成的Cu2(OH)2CO3中会混有少量CuCO3取样品w g,测得n(Cu)=a mol, 则Cu2(OH)2CO3的纯度为
您最近一年使用:0次
2021-02-27更新
|
609次组卷
|
6卷引用:专题15 化学工艺流程-备战2021届高考化学二轮复习题型专练
(已下线)专题15 化学工艺流程-备战2021届高考化学二轮复习题型专练(已下线)第一单元 化学计量在实验中的应用(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)安徽省皖江名校联盟2021届高三下学期开年考(2月)理综化学试题贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题广东省惠州市2022-2023学年高三上学期第二次调研考试 化学试题广东省惠州市2022-2023学年高三上学期第二次调研考试化学试题
名校
解题方法
5 . 苯乙酮() 广泛用于皂用香料和烟草香精中,可由苯和乙酸酐制备。
广泛用于皂用香料和烟草香精中,可由苯和乙酸酐制备。
已知:
步骤Ⅰ:向三颈烧瓶中加入39g苯和44.5g无水氯化铝,在搅拌下滴加25.5g乙酸酐(C4H6O3),在70~80℃下加热45min,发生反应:

步骤Ⅱ:冷却后将反应物倒入100g冰水中,有白色胶状沉淀生成,采用合适的方法处理,水层用苯萃取,合并苯层溶液,再依次用30mL5%NaOH溶液和30mL水洗涤,分离出的苯层用无水硫酸镁干燥。
步骤Ⅲ:常压蒸馏回收苯,再收集产品苯乙酮。
请回答下列问题:
(1)AlCl3在反应中作___________ ,步骤Ⅰ中的加热方式为___________ 。
(2)根据上述实验药品的用量,三颈烧瓶的最适宜规格为___________ (填标号)
A.100mL B.250mL C.500mL D.1000mL
(3)图示实验装置虚线框内缺少一种仪器,该仪器名称为___________ 。
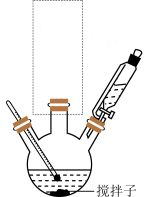
(4)步骤Ⅱ中生成的白色胶状沉淀的化学式为___________ ,可用浓盐处理该沉淀,发生反应的离子方程式为___________ 。
(5)步骤Ⅱ中用NaOH溶液洗涤的目的是___________ 。
(6)实验中收集到24.0mL苯乙酮,则苯乙酮的产率为___________ 。
 广泛用于皂用香料和烟草香精中,可由苯和乙酸酐制备。
广泛用于皂用香料和烟草香精中,可由苯和乙酸酐制备。已知:
| 名称 | 相对分子质量 | 沸点/℃ | 密度(g·mL-1) | 溶解性 |
| 苯 | 78 | 80.1 | 0.88 | 不溶于水,易溶于有机溶剂 |
| 苯乙酮 | 120 | 203 | 1.03 | 微溶于水,易溶于有机溶剂 |
| 乙酸酐 | 102 | 139 | 1.08 | 有吸湿性,易溶于有机溶剂 |
| 乙酸 | 60 | 118 | 1.05 | 易溶于水,易溶于有机溶剂 |

步骤Ⅱ:冷却后将反应物倒入100g冰水中,有白色胶状沉淀生成,采用合适的方法处理,水层用苯萃取,合并苯层溶液,再依次用30mL5%NaOH溶液和30mL水洗涤,分离出的苯层用无水硫酸镁干燥。
步骤Ⅲ:常压蒸馏回收苯,再收集产品苯乙酮。
请回答下列问题:
(1)AlCl3在反应中作
(2)根据上述实验药品的用量,三颈烧瓶的最适宜规格为
A.100mL B.250mL C.500mL D.1000mL
(3)图示实验装置虚线框内缺少一种仪器,该仪器名称为

(4)步骤Ⅱ中生成的白色胶状沉淀的化学式为
(5)步骤Ⅱ中用NaOH溶液洗涤的目的是
(6)实验中收集到24.0mL苯乙酮,则苯乙酮的产率为
您最近一年使用:0次
2021-02-26更新
|
377次组卷
|
3卷引用:第4周 周测卷-备战2022年高考化学周测与晚练(新高考专用)
(已下线)第4周 周测卷-备战2022年高考化学周测与晚练(新高考专用)广东省佛山市顺德区均安中学2021届高三下学期第三次教学质量检测化学试题湖北省武汉市新洲区部分学校2022-2023学年高二下学期期末考试化学试题
解题方法
6 . 试剂级NaCl可用海盐(含泥沙、海藻、K+、 Ca2+、 Mg2+、Fe3+、SO 等杂质)为原料制备。制备流程简图如下:
等杂质)为原料制备。制备流程简图如下:
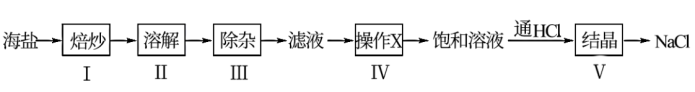
(1)焙炒海盐的目的是______ 。
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
(3)操作X为______ 。
(4)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
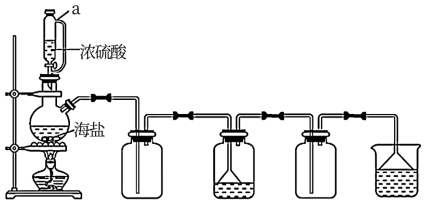
①试剂a为______ 。 相比分液漏斗,选用仪器1的优点是______ 。
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是______ 。
(5)已知:CrO + Ba2+ = BaCrO4↓(黄色)
+ Ba2+ = BaCrO4↓(黄色)
CrO +3Fe2++ 8H+ =Cr3+ + 3Fe3++ 4H2O
+3Fe2++ 8H+ =Cr3+ + 3Fe3++ 4H2O
设计如下实验测定NaCl产品中SO 的含量,填写下列表格。
的含量,填写下列表格。
 等杂质)为原料制备。制备流程简图如下:
等杂质)为原料制备。制备流程简图如下:
(1)焙炒海盐的目的是
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | BaCl2溶液 | SO |
| 步骤2 | ||
| 步骤3 |
(4)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。

①试剂a为
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是
(5)已知:CrO
 + Ba2+ = BaCrO4↓(黄色)
+ Ba2+ = BaCrO4↓(黄色)CrO
 +3Fe2++ 8H+ =Cr3+ + 3Fe3++ 4H2O
+3Fe2++ 8H+ =Cr3+ + 3Fe3++ 4H2O设计如下实验测定NaCl产品中SO
 的含量,填写下列表格。
的含量,填写下列表格。| 操作 | 现象 | 目的/结论 | |
| ① | 称取样品m1g,加水溶解,加盐酸调至弱酸性,滴加过量c1mol·L-1BaCl2溶液V1mL | 稍显浑浊 | 目的: |
| ② | 继续滴加过量c2mol ·L-1 K2CrO4溶液V2 mL | 产生黄色沉淀 | 目的:沉淀过量的Ba2+。 |
| ③ | 过滤洗涤,滴加少许指示剂于滤液中,用c3 mol·L-1FeSO4溶液滴定至终点,消耗FeSO4溶液V3 mL | —— | 结论:SO 的质量分数为 的质量分数为 |
您最近一年使用:0次
名校
解题方法
7 . KMnO4广泛用作氧化剂,可以氧化HCl、FeSO4等。某兴趣小组用Cl2氧化K2MnO4制备KMnO4的装置如下图所示。
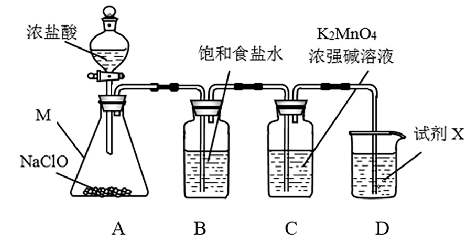
(1)仪器M的名称是_______ 。
(2)装置B的作用是_______ 。
(3)为提高Cl2在装置C中的利用率,在装置A的操作中可采取的措施是_______ 。
(4)试剂X常用浓NaOH溶液,而不用澄清石灰水的主要原因是_______ 。
(5)利用KMnO4测定CuI样品中CuI质量分数(杂质不参与反应)的方法如下:
步骤一:称取CuI样品0.500g,向其中加入足量Fe2(SO4)3溶液,发生反应4Fe3++2CuI=4Fe2++2Cu2++I2。
步骤二:待充分反应后,滴加5.000×10−2mol·L−1KMnO4溶液,发生反应 +5Fe2++8H+=Mn2++5Fe3++4H2O,至恰好完全反应消耗KMnO4溶液20.00mL。
+5Fe2++8H+=Mn2++5Fe3++4H2O,至恰好完全反应消耗KMnO4溶液20.00mL。
计算该样品中碘化亚铜的质量分数(写出计算过程)。_______

(1)仪器M的名称是
(2)装置B的作用是
(3)为提高Cl2在装置C中的利用率,在装置A的操作中可采取的措施是
(4)试剂X常用浓NaOH溶液,而不用澄清石灰水的主要原因是
(5)利用KMnO4测定CuI样品中CuI质量分数(杂质不参与反应)的方法如下:
步骤一:称取CuI样品0.500g,向其中加入足量Fe2(SO4)3溶液,发生反应4Fe3++2CuI=4Fe2++2Cu2++I2。
步骤二:待充分反应后,滴加5.000×10−2mol·L−1KMnO4溶液,发生反应
 +5Fe2++8H+=Mn2++5Fe3++4H2O,至恰好完全反应消耗KMnO4溶液20.00mL。
+5Fe2++8H+=Mn2++5Fe3++4H2O,至恰好完全反应消耗KMnO4溶液20.00mL。计算该样品中碘化亚铜的质量分数(写出计算过程)。
您最近一年使用:0次
2021-01-05更新
|
228次组卷
|
4卷引用:2020年山东卷化学高考真题变式题16-20
(已下线)2020年山东卷化学高考真题变式题16-20江苏省扬州市2021年普通高中学业水平检测模拟化学试题江苏省盐城市伍佑中学2022-2023学年高二上学期期中考试化学(必修)试题江苏省宿迁市沭阳县潼阳中学2021-2022学年高二上学期期中考试化学试题
2020高三·全国·专题练习
解题方法
8 . 亚硝酸钙是一种阻锈剂,可用于燃料工业,某兴趣小组拟测定制备Ca(NO2)2的纯度。
[背景素材]
Ⅰ.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO ,MnO
,MnO 被还原为Mn2+。
被还原为Mn2+。
Ⅲ.亚硝酸不稳定,易分解,且有一定氧化性,在酸性条件下,Ca(NO2)2能将I-氧化为I2,2NO +4H++2I-=I2+2NO↑+2H2O,S2O
+4H++2I-=I2+2NO↑+2H2O,S2O 能将I2还原为I-,I2+2S2O
能将I2还原为I-,I2+2S2O =2I-+S4O
=2I-+S4O 。
。
某组同学测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:a.稀硫酸b.c1mol·L-1的KI溶液c.淀粉溶液d.c2mol·L-1的Na2S2O3溶液e.c3mol·L-1的酸性KMnO4溶液
(1)利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是___ (填字母序号)。该测定方法发生反应的离子方程式为___ 。
(2)利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,加入___ ,然后滴加稀硫酸,用c2mol·L-1Na2S2O3溶液滴定至溶液___ ,读取消耗Na2S2O3溶液的体积,重复以上操作3次,(请用上述给出试剂补充完整实验步骤)。若三次消耗Na2S2O3溶液的平均体积为VmL,则Ca(NO2)2纯度的表达式为___ 。
[背景素材]
Ⅰ.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO
 ,MnO
,MnO 被还原为Mn2+。
被还原为Mn2+。Ⅲ.亚硝酸不稳定,易分解,且有一定氧化性,在酸性条件下,Ca(NO2)2能将I-氧化为I2,2NO
 +4H++2I-=I2+2NO↑+2H2O,S2O
+4H++2I-=I2+2NO↑+2H2O,S2O 能将I2还原为I-,I2+2S2O
能将I2还原为I-,I2+2S2O =2I-+S4O
=2I-+S4O 。
。某组同学测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:a.稀硫酸b.c1mol·L-1的KI溶液c.淀粉溶液d.c2mol·L-1的Na2S2O3溶液e.c3mol·L-1的酸性KMnO4溶液
(1)利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是
(2)利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,加入
您最近一年使用:0次
2020-12-09更新
|
794次组卷
|
5卷引用:专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测
(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测(已下线)解密02 物质的量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密02 物质的量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)04 定量分析型综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型48 物质含量测定型综合实验
名校
解题方法
9 . 某实验小组欲通过测定单位时间内酸性KMnO4溶液和H2C2O4(草酸)溶液反应生成CO2的体积,探究影响该化学反应速率的因素,设计的实验方案如下(KMnO4溶液已酸化),实验装置如图所示。
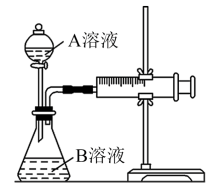
(1)写出酸性KMnO4溶液和H2C2O4(草酸)溶液反应的离子方程式____ 。
(2)该实验探究的是____ 因素对化学反应速率的影响;相同时间内针筒中所得CO2的体积大小关系是①____ ②(填“>”、“<”或“=”)。
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c( )=
)=___ mol/L。(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定___ 来比较化学反应速率。
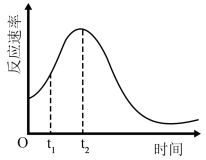
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、②____ 。

实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol/LH2C2O4溶液 | 30mL0.01mol/LKMnO4溶液 |
② | 20mL0.2mol/LH2C2O4溶液 | 30mL0.01mol/LKMnO4溶液 |
(2)该实验探究的是
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(
 )=
)=(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、②

您最近一年使用:0次
2020高三·全国·专题练习
10 . 某学生为测定某烧碱样品中NaOH的质量分数,进行如下实验(已知该样品中含有少量不与酸作用的杂质):
A.在250 mL 容量瓶中定容,配制成250 mL 烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL 烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品20.5 g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为1.00 mol/L 的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液变为橙色为止,记录终点耗酸体积V2 mL
回答下列问题:
(1)正确的操作步骤的顺序是(填写字母)______ →______ →________ →______ →______ 。
(2)滴定管读数应注意________________________________ 。
(3)E步骤的操作中在锥形瓶下垫一张白纸的作用是__________________ 。
(4)下列操作中可能使所测NaOH的质量分数偏低的是________ (填字母)。
a.A步操作中未将溶液冷却至室温就转移到容量瓶中定容
b.C步操作中,称量药品时,砝码放在左盘,NaOH放在右盘
c.D步操作中酸式滴定管在装入标准H2SO4溶液前未用标准液润洗
d.读取硫酸体积时,开始时仰视读数,结束时俯视读数
(5)硫酸的初读数和末读数如图所示。末读数为______ mL,初读数为____ mL,用量为________ mL。按滴定所得数据来计算出的烧碱样品中NaOH的质量分数为________ 。
A.在250 mL 容量瓶中定容,配制成250 mL 烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL 烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品20.5 g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为1.00 mol/L 的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液变为橙色为止,记录终点耗酸体积V2 mL
回答下列问题:
(1)正确的操作步骤的顺序是(填写字母)
(2)滴定管读数应注意
(3)E步骤的操作中在锥形瓶下垫一张白纸的作用是
(4)下列操作中可能使所测NaOH的质量分数偏低的是
a.A步操作中未将溶液冷却至室温就转移到容量瓶中定容
b.C步操作中,称量药品时,砝码放在左盘,NaOH放在右盘
c.D步操作中酸式滴定管在装入标准H2SO4溶液前未用标准液润洗
d.读取硫酸体积时,开始时仰视读数,结束时俯视读数
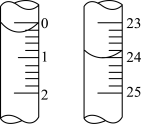
(5)硫酸的初读数和末读数如图所示。末读数为
您最近一年使用:0次



