1 .  表示阿伏加德罗常数。下列说法正确的是
表示阿伏加德罗常数。下列说法正确的是
 表示阿伏加德罗常数。下列说法正确的是
表示阿伏加德罗常数。下列说法正确的是A.2g氘化锂(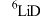 )中含有的中子数为2 )中含有的中子数为2 |
B.25℃时,1L0.1  溶液中阳离子数小于0.2 溶液中阳离子数小于0.2 |
C.28g 和 和 的混合气体完全燃烧生成CO2的分子数介于2 的混合气体完全燃烧生成CO2的分子数介于2 ~3 ~3 |
D.标准状况下,22.4L氖气含有的原子数约为 |
您最近一年使用:0次
解题方法
2 . 过量 NaOH 浓溶液和白磷加热煮沸可发生反应: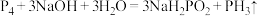 。
。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
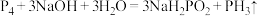 。
。 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.46.5g 所含σ键数为9 NA 所含σ键数为9 NA |
B. 为一元酸, 为一元酸, 为酸式盐 为酸式盐 |
C.生成0.2mol P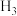 时, 转移电子数为0.6 NA 时, 转移电子数为0.6 NA |
D.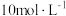 的 NaOH 溶液所含 OH⁻的数目为10 NA 的 NaOH 溶液所含 OH⁻的数目为10 NA |
您最近一年使用:0次
3 . 某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据:
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为
| 硫酸铜溶液 | I | II | III | IV |
| 加入的无水硫酸铜(g) | 2.5 | 4.0 | 6.0 | 8.0 |
| 析出的硫酸铜晶体(g) | 0.1 | 2.8 | 6.4 | 10.0 |
| A.3.42g | B.3.88g | C.6.82g | D.2.56g |
您最近一年使用:0次
名校
4 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.32g  中所含共价键数目为 中所含共价键数目为 |
B.0.1  溶液中所含 溶液中所含 数目少于0.1 数目少于0.1 |
C.标准状况下,22.4L  溶于足量NaOH溶液中,转移电子数目为2 溶于足量NaOH溶液中,转移电子数目为2 |
D.将10g铁粉加入稀硝酸中,最终有4.4g铁未溶解,该过程中转移电子数目为0.3 |
您最近一年使用:0次
名校
5 . 设 为阿伏伽德罗常数的值。下列说法不正确的是
为阿伏伽德罗常数的值。下列说法不正确的是
 为阿伏伽德罗常数的值。下列说法不正确的是
为阿伏伽德罗常数的值。下列说法不正确的是A.100mL pH=1的 溶液中含有 溶液中含有 的数目为0.01 的数目为0.01 |
B.25℃,101KPa下,56g CO和 的混合气体的体积约为49L 的混合气体的体积约为49L |
C.1mol  中含有σ键的个数为10 中含有σ键的个数为10 |
D.1mol 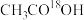 与足量乙醇反应生成 与足量乙醇反应生成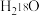 的数目为 的数目为 |
您最近一年使用:0次
名校
6 . 氮化硅陶瓷,被誉为“先进陶瓷材料皇冠上的明珠”。氮化硅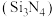 可由石英与焦炭在高温的氮气气流中通过以下反应制备:
可由石英与焦炭在高温的氮气气流中通过以下反应制备: 。设
。设 为阿伏伽德罗常数的值:下列说法正确的是
为阿伏伽德罗常数的值:下列说法正确的是
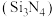 可由石英与焦炭在高温的氮气气流中通过以下反应制备:
可由石英与焦炭在高温的氮气气流中通过以下反应制备: 。设
。设 为阿伏伽德罗常数的值:下列说法正确的是
为阿伏伽德罗常数的值:下列说法正确的是A. 中含 中含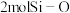 键 键 |
B.每生成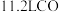 转移电子数目为 转移电子数目为 |
C.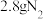 中含有的π键数目为 中含有的π键数目为 |
D.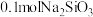 晶体中含离子数目小于 晶体中含离子数目小于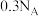 |
您最近一年使用:0次
7 . NA代表阿伏加德罗常数的值,下列说法正确的是
| A.22.4L甲醛所含σ键数为4NA |
| B.0.1mol·L-1的MgCl2溶液含Cl-的数目为0.1NA |
| C.82g Na218O2与足量水完全反应,电子转移数为2NA |
| D.0.1mol的C2H5OH所含氢原子数为0.6NA |
您最近一年使用:0次
名校
8 . 设 为阿伏加德罗常数的值,下列有关说法正确的是
为阿伏加德罗常数的值,下列有关说法正确的是
 为阿伏加德罗常数的值,下列有关说法正确的是
为阿伏加德罗常数的值,下列有关说法正确的是A.20g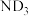 溶于水形成的氨水中质子数约为 溶于水形成的氨水中质子数约为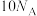 |
B.标准状况下,2.24L 中含 中含 型 型 键数目为 键数目为 |
C. 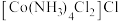 溶于水可电离出 溶于水可电离出 个 个 |
D.等物质的量的 和 和 所含有的电子数均为 所含有的电子数均为 |
您最近一年使用:0次
9 . NA为阿伏加德罗常数的值。下列叙述正确的是
| A.0.5mol异丁烷分子中共价键的数目为6.5NA |
B.1.7g 中含有氧原子数为0.2NA 中含有氧原子数为0.2NA |
C.1mol晶体Si含Si-Si键的数目约为 |
D.标准状况下,0.5NA 分子所占的体积约为11.2L 分子所占的体积约为11.2L |
您最近一年使用:0次
名校
10 . 锗是一种重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。如图为工业上利用湿法炼锌渣(主要含有 、
、 、
、 、
、 、
、 )制备高纯锗的工艺流程:
)制备高纯锗的工艺流程: 为两性化合物。②
为两性化合物。② 易水解,在浓盐酸中溶解度低。
易水解,在浓盐酸中溶解度低。
③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见表。
④有机试剂丹宁沉淀金属离子的沉淀率见表。
(1)“浸出”时加热的目的是_______ ,该过程发生的主要反应为_______ ;浸出渣的主要成分是_______ (填化学式)。
(2)浸出后加入 溶液的作用是
溶液的作用是_______ (用离子方程式表示)。滤饼1中主要成分为一种,常温下调节溶液的pH范围为_______ 。如果不加 溶液,pH就需要调节到更大的数值,这样会造成
溶液,pH就需要调节到更大的数值,这样会造成_______ 的不良后果。
(3)“滤液2”中主要含有的金属阳离子是_______ (填离子符号)。
(4) 与纯水反应的化学方程式为
与纯水反应的化学方程式为_______ 。
(5)若含锗3.65%的湿法炼锌渣的质量为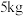 ,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为_______ 。
 、
、 、
、 、
、 、
、 )制备高纯锗的工艺流程:
)制备高纯锗的工艺流程: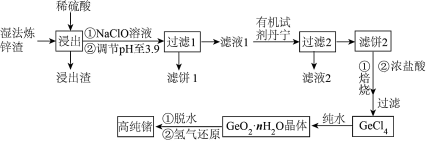
 为两性化合物。②
为两性化合物。② 易水解,在浓盐酸中溶解度低。
易水解,在浓盐酸中溶解度低。③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见表。
| 离子 |  |  |  |  |
| 开始沉淀pH | 7.5 | 2.2 | 6.2 | 8.2 |
| 完全沉淀pH | 9.0 | 3.2 | 8.2 | 11.2 |
| 离子 |  |  |  |  |
| 沉淀率(%) | 0 | 99 | 0 | 97~98.5 |
(2)浸出后加入
 溶液的作用是
溶液的作用是 溶液,pH就需要调节到更大的数值,这样会造成
溶液,pH就需要调节到更大的数值,这样会造成(3)“滤液2”中主要含有的金属阳离子是
(4)
 与纯水反应的化学方程式为
与纯水反应的化学方程式为(5)若含锗3.65%的湿法炼锌渣的质量为
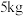 ,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
您最近一年使用:0次
2024-04-21更新
|
277次组卷
|
3卷引用:四川省绵阳南山中学2024届高三下学期三诊热身考试理综-化学试题



