1 . 工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如图所示。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g) 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_______ ,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_______ 。
(2)反应III为:CO2(g)+C(s)⇌2CO(g) ∆H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_______ (任写一条措施)。
(3)流程图中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_______ 。
(4)①高铁酸盐是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
若生成2mol Na2FeO4,则反应中电子转移的物质的量为_______ mol。
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+ 1mg的水体样本,需要1.2mg·L-1高铁酸钾_______ L。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为(2)反应III为:CO2(g)+C(s)⇌2CO(g) ∆H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有
(3)流程图中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为
(4)①高铁酸盐是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
若生成2mol Na2FeO4,则反应中电子转移的物质的量为
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+ 1mg的水体样本,需要1.2mg·L-1高铁酸钾
您最近一年使用:0次
名校
2 . 磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有 Al 箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
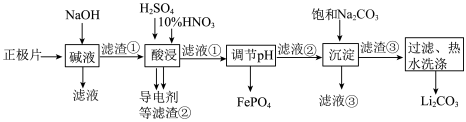
(1)从“正极”可以回收的金属有_______ 。
(2)“碱溶”时 Al 箔溶解的离子方程式为_______ 。
(3)“酸浸”时产生标况下2.24 L NO时,被氧化的LiFePO4为_______ mol(其他杂质不与HNO3反应)。
(4)磷酸亚铁锂电池总反应为:LiFePO4+6C Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______ (填“阳极”或“阴极”);放电时,正极反应式为_______ 。
(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取 1.40 g 试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入 HgCl2 饱和溶液,用二苯胺磺酸钠作指示剂,用 0.030 mol·L-1 重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00 mL。
已知:2Fe3++Sn2++6Cl-=SnCl +2Fe2+
+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl +Hg2Cl2
+Hg2Cl2
6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是_______ 。
②磷酸亚铁锂电池中铁的含量为_______ 。

(1)从“正极”可以回收的金属有
(2)“碱溶”时 Al 箔溶解的离子方程式为
(3)“酸浸”时产生标况下2.24 L NO时,被氧化的LiFePO4为
(4)磷酸亚铁锂电池总反应为:LiFePO4+6C
 Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取 1.40 g 试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入 HgCl2 饱和溶液,用二苯胺磺酸钠作指示剂,用 0.030 mol·L-1 重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00 mL。
已知:2Fe3++Sn2++6Cl-=SnCl
 +2Fe2+
+2Fe2+4Cl-+Sn2++2HgCl2=SnCl
 +Hg2Cl2
+Hg2Cl26Fe2++Cr2O
 +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O①实验中加入HgCl2饱和溶液的目的是
②磷酸亚铁锂电池中铁的含量为
您最近一年使用:0次
3 . 设NA为阿伏加 德罗常数的值,下列说法正确的是( )
| A.标准状况下,含NA个分子的H2、CO混合气体的体积约为22.4L |
| B.56g铁与一定量的氯气在一定条件下充分反应,转移的电子数一定是3NA |
| C.28g乙烯与C3H8的混合物中含有C—H键的数目为4NA |
| D.常温下,pH=11的NaOH溶液中由水电离出的H+数目为0.001NA |
您最近一年使用:0次
2020-09-19更新
|
171次组卷
|
2卷引用:四川省射洪中学校2021届高三上学期第一次月考理综化学试题(补习班)
名校
解题方法
4 . 设NA为阿伏加 德罗常数的值。下列说法正确的是
| A.0.01mol•L-1KAl(SO4)2溶液中的SO42-数目为0.02NA |
| B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA |
| C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA |
| D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA |
您最近一年使用:0次
2020-05-24更新
|
417次组卷
|
3卷引用:河北省保定市2020年高三第二次模拟理科综合化学试题
5 . 设阿伏加 德罗常数的值为N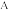 ,关于反应
,关于反应 下列说法错误的是
下列说法错误的是
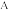 ,关于反应
,关于反应 下列说法错误的是
下列说法错误的是| A.8.8gCO2中共用电子对的数目为0.8NA |
| B.消耗CO24.48L(标准状况下)时转移电子的数目为0.8NA |
| C.12g金刚石(C)中所含共价键的数目为4NA |
| D.0.1molMgO中所有离子的最外层电子数之和为1.6NA |
您最近一年使用:0次
2013·上海·零模
解题方法
6 . 以NA表示阿伏加德罗常数,下列说法中正确的是( )
| A.标准状况下0.5NA个Br2所占的体积约为11.2L |
| B.15.6g 过氧化钠固体中含有的阴离子数目为0.2NA |
| C.1mol Cl2通入足量的水中充分反应转移的电子数为2NA |
| D.将0.2mol的硫化钾配成1升溶液,溶液中阴离子数目肯定多于0.2NA |
您最近一年使用:0次
12-13高三·广东惠州·阶段练习
7 . 设阿伏加德罗常数为NA,下列说法正确的是
| A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B.1mol NH3含有的电子数10NA |
| C.常温常压下,22.4 L的氧气含氧原子数为2NA |
| D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA |
您最近一年使用:0次
8 . NA表示阿伏加德罗常数的值。下列说法中正确的是
①常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
②常温常压下,18gH2O中含有的电子总数为10NA
③将100 mL 0.1 mol·L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
④在反应KIO3+6HI==KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA
⑤常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA
⑥在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75 NA
⑦1.0L 1.0 mol·L-1 Na2SiO3水溶液中含有的氧原子数为3NA
①常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
②常温常压下,18gH2O中含有的电子总数为10NA
③将100 mL 0.1 mol·L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
④在反应KIO3+6HI==KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA
⑤常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA
⑥在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75 NA
⑦1.0L 1.0 mol·L-1 Na2SiO3水溶液中含有的氧原子数为3NA
| A.①⑤⑦ | B.③④⑥ |
| C.②④⑤ | D.②③⑦ |
您最近一年使用:0次
2016-11-09更新
|
290次组卷
|
3卷引用:2017届山东省济南一中高三上学期期中化学试卷



