河北省保定市2020年高三第二次模拟理科综合化学试题
河北
高三
二模
2020-05-27
773次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、认识化学科学、化学反应原理、化学实验基础、物质结构与性质
河北省保定市2020年高三第二次模拟理科综合化学试题
河北
高三
二模
2020-05-27
773次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、认识化学科学、化学反应原理、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
1. 化学与生活密切相关。下列说法错误的是
| A.在食品袋中放入盛有硅胶的透气小袋,可防止被盛装食品受潮 |
| B.淀粉可用于制取葡萄糖、乙醇、乙酸 |
| C.化妆品中添加甘油,具有保湿效果 |
| D.使用75%的酒精、0.1%的次氯酸钠和1%的食盐水均可以快速高效杀死新冠病毒 |
【知识点】 蛋白质的变性 化学科学对人类文明发展的意义解读
您最近一年使用:0次
2020-05-24更新
|
495次组卷
|
4卷引用:河北省保定市2020年高三第二次模拟理科综合化学试题
河北省保定市2020年高三第二次模拟理科综合化学试题(已下线)专题01 STSE 化学用语-2020年高考真题和模拟题化学分项汇编(已下线)专题01 物质的组成、性质和分类——备战2021年高考化学纠错笔记安徽省滁州市定远县育才学校2020-2021学年高一下学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
2. 设NA为阿伏加 德罗常数的值。下列说法正确的是
| A.0.01mol•L-1KAl(SO4)2溶液中的SO42-数目为0.02NA |
| B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA |
| C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA |
| D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA |
您最近一年使用:0次
2020-05-24更新
|
417次组卷
|
3卷引用:河北省保定市2020年高三第二次模拟理科综合化学试题
单选题
|
较难(0.4)
名校
解题方法
3. 下列实验操作与实验现象或结论不相匹配的是
| 实验操作 | 实验现象或结论 | |
| A | 向2支均盛有2mL1.0mol•L-1KOH溶液的试管中分别加入2滴浓度均为0.lmol•L-1的AlCl3和MgCl2溶液,加入MgCl2溶液的试管出现白色沉淀,另一支无明显现象 | Ksp [A1(OH)3]>Ksp[Mg(OH)2] |
| B | 向盛有KI溶液的试管中滴加氯水和CCl4液体,振荡 | 下层溶液变为紫红色 |
| C | 室温下,用pH试纸分别测0.lmol•L-1Na2SO3和0.1mol•L-1Na2CO3溶液的pH | Na2SO3溶液的pH约为10,Na2CO3溶液的pH约为12,则说明CO32-水解的能力比SO32-的强 |
| D | 向盛有Na2S2O3溶液的试管中先滴入酚酞溶液,然后滴加盐酸,边滴边振荡 | 溶液先变红后褪色,有气泡产生并出现浑浊 |
| A.A | B.B | C.C | D.D |
【知识点】 沉淀转化解读 物质性质实验方案的设计解读
您最近一年使用:0次
2020-05-24更新
|
747次组卷
|
3卷引用:河北省保定市2020年高三第二次模拟理科综合化学试题
单选题
|
较难(0.4)
名校
解题方法
4. 某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示。下列说法正确的是
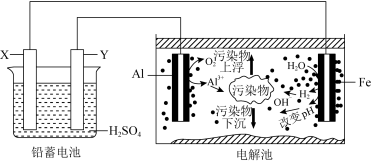

| A.Y电极反应为Pb+SO42--2e-=PbSO4 |
| B.每消耗103.5gPb, 理论上电解池阴极上有1molH2生成 |
C.该电解池的总反应为2Al+6H2O 2Al(OH)3+3H2↑ 2Al(OH)3+3H2↑ |
| D.若污水为含有Cr2O72-工业酸性废水,为将其转化为Cr3+除去,可让铁电极连接铅蓄电池的正极 |
您最近一年使用:0次
2020-05-24更新
|
496次组卷
|
2卷引用:河北省保定市2020年高三第二次模拟理科综合化学试题
单选题
|
较易(0.85)
名校
解题方法
5. 化合物丙是一种医药中间体,可以通过如图反应制得。下列说法正确的是
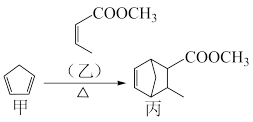

| A.丙的分子式为C10H16O2 |
| B.乙可以发生取代反应、加成反应、氧化反应 |
| C.甲的一氯代物有4种(不考虑立体异构) |
| D.甲、丙均不能使酸性高锰酸钾溶液褪色 |
您最近一年使用:0次
2022-07-20更新
|
186次组卷
|
5卷引用:河北省保定市2020年高三第二次模拟理科综合化学试题
河北省保定市2020年高三第二次模拟理科综合化学试题(已下线)专题12 有机化合物-2020年高考真题和模拟题化学分项汇编云南省丽江市2021-2022学年高一下学期期末考试化学试题江苏省锡东高级中学2022-2023学年高一5月阶段性考试化学试题天津市宝坻区第一中学2022-2023学年高一下学期阶段练习四化学试题
单选题
|
适中(0.65)
解题方法
6. A、B、C、D、E五种短周期主族元素,原子序数依次增大。A是元素周期表中原子半径最小的元素;C元素最高价氧化物对应的水化物是一种强碱;B、D、E的最外层电子数之和为19且B的一种单质可用于饮用水消毒。下列说法错误的是
| A.B、C、D的简单离子半径:D>B>C |
| B.B与A、C、D、E四种元素均可形成两种或两种以上化合物 |
| C.由B、C、E三种元素形成的化合物溶于水均能促进水的电离 |
| D.分子D2E2中原子均满足8电子稳定结构,则分子中存在非极性键 |
您最近一年使用:0次
单选题
|
较难(0.4)
解题方法
7. 常温下,向20mL0.05mol•L-1的某稀酸H2B溶液中滴入0.1mol•L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
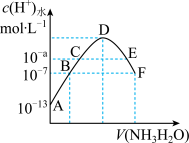

| A.NaHB溶液中一定含有H2B分子 |
| B.A、B、C三点溶液的pH逐渐减小,D、E、F三点溶液的pH逐渐增大 |
| C.E溶液中离子浓度大小关系为c(NH4+)>c(B2-)>c(H+)>c(OH-) |
| D.B点溶液pH=7 |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
名校
解题方法
8. 金属铋在自然界中的量极少,用途非常广泛,通常以辉铋矿为原料提取金属铋,工艺流程如图所示:
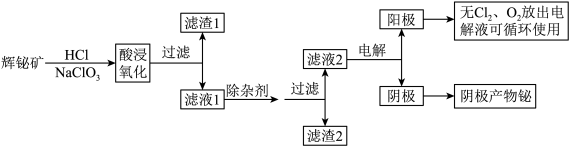
已知:①辉铋矿主要成分是Bi2S3,还含少量Bi2O3、SiO2、铁的氧化物和硫化物等。
②Bi2O3能溶于酸,NaBiO3不溶于水。
③常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Bi (OH)3]=4×10-30;Ksp[Fe(OH)2]=8.0×10-16;
回答下列问题:
(1)写出酸浸氧化时Bi2S3被氧化成硫单质的化学方程式_______________ 。
(2)滤渣1的成分为_______________ 。
(3)除杂剂的作用a.调节溶液pH,b_______________ ,写出一种能提高产物产量的除杂剂_______________ 。
(4)滤液2还可用来制备NaBiO3,可向滤液2中加入NaOH和NaClO溶液制取NaBiO3,写出该反应的离子方程式_______________ 。
(5)滤液2采用电解法制取金属铋单质,阳极产物处理后可继续循环使用,电解装置如图所示。
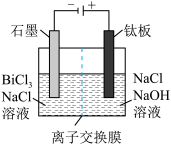
①交换膜类型为_______________ (填“Cl-”或“OH-”)交换膜。
②阳极电极反应式为_______________ 。

已知:①辉铋矿主要成分是Bi2S3,还含少量Bi2O3、SiO2、铁的氧化物和硫化物等。
②Bi2O3能溶于酸,NaBiO3不溶于水。
③常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Bi (OH)3]=4×10-30;Ksp[Fe(OH)2]=8.0×10-16;
回答下列问题:
(1)写出酸浸氧化时Bi2S3被氧化成硫单质的化学方程式
(2)滤渣1的成分为
(3)除杂剂的作用a.调节溶液pH,b
(4)滤液2还可用来制备NaBiO3,可向滤液2中加入NaOH和NaClO溶液制取NaBiO3,写出该反应的离子方程式
(5)滤液2采用电解法制取金属铋单质,阳极产物处理后可继续循环使用,电解装置如图所示。

①交换膜类型为
②阳极电极反应式为
【知识点】 物质分离、提纯综合应用解读 常见无机物的制备解读
您最近一年使用:0次
2020-05-24更新
|
262次组卷
|
2卷引用:河北省保定市2020年高三第二次模拟理科综合化学试题
解答题-实验探究题
|
较难(0.4)
解题方法
9. 硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解所得产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物(铁的氧化物、硫的氧化物、含氮物质、水)的具体成分(已知每个装置中的药品足量)。
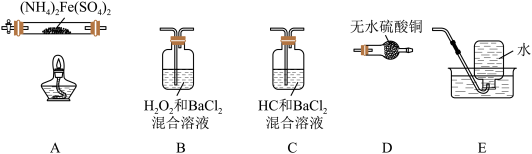
(1)利用上述装置完成该实验,则该装置的正确连接顺序为_______________ (用装置下面的字母填连接顺序,每个装置都要使用)。加热A前需要通入一段时间N2目的是_______________ 。
(2)若观察到B中有白色沉淀生成,C中无明显现象,则装置C的作用为_______________ ,D中白色变为蓝色,写出B中发生反应的离子方程式_______________ 装置B与装置C能否互换_______________ (填 “能”或“否”),原因是_______________ (填“能”则不填此空)。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容(试剂,仪器和用品自选)。
(4)硫酸亚铁铵在500℃时隔绝空气加热完全分解,若E中收集到的气体只有N2,A中固体残留物Fe2O3的质量为80g,B中沉淀物质的量为2rnol,则生成N2的质量为_______________ g。
(5)某含铬(Cr2O72-)废水用硫酸亚铁铵溶液滴定处理,反应后铁元素和铬元素完全转化为沉淀(沉淀中铬元素化合价为+3),该沉淀经干燥后得到amolFeO•FemCrnO3,不考虑处理过程中的实际损耗,则消耗硫酸亚铁铵的物质的量为_______________ mol(用a的代数式表示)。

(1)利用上述装置完成该实验,则该装置的正确连接顺序为
(2)若观察到B中有白色沉淀生成,C中无明显现象,则装置C的作用为
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容(试剂,仪器和用品自选)。
| 实验步骤 | 预期现象 | 结论 |
| 固本残留物仅为Fe2O3 |
(5)某含铬(Cr2O72-)废水用硫酸亚铁铵溶液滴定处理,反应后铁元素和铬元素完全转化为沉淀(沉淀中铬元素化合价为+3),该沉淀经干燥后得到amolFeO•FemCrnO3,不考虑处理过程中的实际损耗,则消耗硫酸亚铁铵的物质的量为
【知识点】 探究物质组成或测量物质的含量解读 综合实验设计与评价解读
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
名校
解题方法
10. 将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
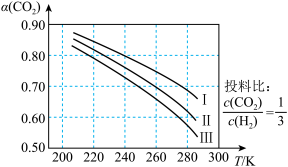
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________ 反应(填“放热”或“吸热")。设CO2的初始浓度为comol•L-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________ (填“上方”或“下方”)。
(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下
则该反应的△H=_______________ k.J•mol-1 。
(3)已知:①CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226kJ•rnol-1
CO2(g)+NO(g) △H1=-226kJ•rnol-1
②N2(g)+2O2(g) 2NO2(g)△H2=+68kJ•mol-1
2NO2(g)△H2=+68kJ•mol-1
③N2(g)+O2(g) 2NO(g) △H3=+183kJ•mol-1
2NO(g) △H3=+183kJ•mol-1
则:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=
2CO2(g)+N2(g) △H=_______________ kJ•mol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的速率的是
CH3OH(g)+H2O(g)的速率的是_______________ (填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2、Al(NO3)3混合液加入氨水调节pH=12(常温),然后将浊液高压恒温放置及煅烧等操作制备该催化剂。加入氨水调节pH=12时,c(Ni2+)为_______________ 。[已知:Ksp[Ni(OH)2]=5×10-16]
 CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为

(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下| 共价键 | C—O | H—O | N—H | C—N |
| 键能/k.J•mol-1 | 351 | 463 | 393 | 293 |
(3)已知:①CO(g)+NO2(g)
 CO2(g)+NO(g) △H1=-226kJ•rnol-1
CO2(g)+NO(g) △H1=-226kJ•rnol-1②N2(g)+2O2(g)
 2NO2(g)△H2=+68kJ•mol-1
2NO2(g)△H2=+68kJ•mol-1③N2(g)+O2(g)
 2NO(g) △H3=+183kJ•mol-1
2NO(g) △H3=+183kJ•mol-1则:2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H=
2CO2(g)+N2(g) △H=(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的速率的是
CH3OH(g)+H2O(g)的速率的是A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2、Al(NO3)3混合液加入氨水调节pH=12(常温),然后将浊液高压恒温放置及煅烧等操作制备该催化剂。加入氨水调节pH=12时,c(Ni2+)为
您最近一年使用:0次
2020-05-24更新
|
929次组卷
|
7卷引用:河北省保定市2020年高三第二次模拟理科综合化学试题
河北省保定市2020年高三第二次模拟理科综合化学试题四川省棠湖中学2020届高三第二次高考适应性考试理综化学试题(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记四川省泸县第五中学2022届高三三诊模拟考试理科综合化学试题四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题四川省泸县第一中学2023-2024学年高三上学期10月月考理综化学试题
解答题-结构与性质
|
适中(0.65)
解题方法
11. 碱式碳酸镁是橡胶制品的优良填充剂及补强剂,补强效果优于碳酸钙及陶土,其折射率与天然橡胶相近,适于制造透明或半透明制品。碱式碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
回答下列问题:
(1)碱式碳酸镁中各元素的第一电离能由大到小的顺序为_______________ ,写出一种与CO32-互为等电子体的常见微粒_______________ ,原子序数与CO32-的价电子数之和相等的基态原子的价电子排布式为________ 。
(2)碱式碳酸镁晶体生长液中生长的3种生长基元的结构如图所示:

①(MgCl4)2-;②H2CO3;③[Mg(OH)4]2-
①和③中Mg原子的杂化方式为_______________ ,②中C原子的价电子对的几何分布形式为_______________ 。(MgCl4)2-中镁氯原子之间的距离R=0.25nm,则氯氯原子之间的距离为_______________ (保留两位小数,已知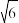 =2.45,cosl09°28'=
=2.45,cosl09°28'= )。
)。
(3)碱式碳酸镁加热可分解生成MgO。已知MgO的晶体结构属于NaCl型,某同学画出的MgO晶胞结构如图所示:
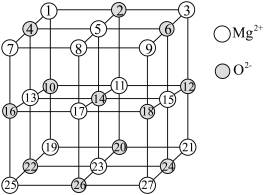
①请改正图中错误_______________ (用文字表述)。
②在MgO晶体中,Mg2+的配位数为_______________ ,每个晶胞中所包含的Mg2+数目为_______________ ,每个Mg2+距离最近的且等距离的Mg2+数目为_______________ 。
③和某些离子化合物相比,MgO是一种优良的耐高温材料的内在原因为_______________ 。
回答下列问题:
(1)碱式碳酸镁中各元素的第一电离能由大到小的顺序为
(2)碱式碳酸镁晶体生长液中生长的3种生长基元的结构如图所示:

①(MgCl4)2-;②H2CO3;③[Mg(OH)4]2-
①和③中Mg原子的杂化方式为
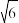 =2.45,cosl09°28'=
=2.45,cosl09°28'= )。
)。(3)碱式碳酸镁加热可分解生成MgO。已知MgO的晶体结构属于NaCl型,某同学画出的MgO晶胞结构如图所示:

①请改正图中错误
②在MgO晶体中,Mg2+的配位数为
③和某些离子化合物相比,MgO是一种优良的耐高温材料的内在原因为
您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
解题方法
12. 烃A常用于有机合成及用作色谱分析的标准物质,其相对分子质量为82,分子中含有两个碳碳双键、无支链,其中核磁共振氢谱有3组峰,且峰面积比为2:2:1。D无酸性,相对分子质量为202。F为高分子化合物(C10H14O4)n。有机物A、B、C、D、E、F之间的转化关系如图:
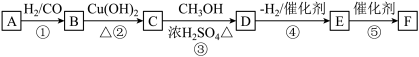
已知:①RCH=CH2 RCH(CH3)CHO
RCH(CH3)CHO
②(CH3)2CHCOOR CH2=C(CH3)COOR
CH2=C(CH3)COOR
回答下列问题:
(1)⑤的反应类型为_______________ ,E中含氧官能团的名称为_______________ 。
(2)用系统命名法命名的A的名称为_______________ 。
(3)下列有关物质A的说法错误的是_______________ 。
a.A能使酸性高锰酸钾溶液褪色 b.A分子中最少有三个碳原子共面
c.A分子中存在两种顺反异构 d.A分子一定条件下能发生加聚反应
(4)写出②的化学方程式_______________
(5)G与有机物D互为同系物,比D分子少6个碳原子,满足下列条件的G的同分异构体有_______________ 种(不考虑立体异构)。
a.1molG与碳酸氢钠溶液反应生成1molCO2
b.1molG与NaOH溶液反应消耗2moLNaOH
以上同分异构体中,任意写出一种满足核磁共振氢谱有3组峰的有机物的结构简式_______________ 。
(6)参照上述已知中的信息,以乙烯为原料(无机试剂任选),设计制备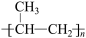 的路线。
的路线。_______________

已知:①RCH=CH2
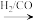 RCH(CH3)CHO
RCH(CH3)CHO②(CH3)2CHCOOR
 CH2=C(CH3)COOR
CH2=C(CH3)COOR回答下列问题:
(1)⑤的反应类型为
(2)用系统命名法命名的A的名称为
(3)下列有关物质A的说法错误的是
a.A能使酸性高锰酸钾溶液褪色 b.A分子中最少有三个碳原子共面
c.A分子中存在两种顺反异构 d.A分子一定条件下能发生加聚反应
(4)写出②的化学方程式
(5)G与有机物D互为同系物,比D分子少6个碳原子,满足下列条件的G的同分异构体有
a.1molG与碳酸氢钠溶液反应生成1molCO2
b.1molG与NaOH溶液反应消耗2moLNaOH
以上同分异构体中,任意写出一种满足核磁共振氢谱有3组峰的有机物的结构简式
(6)参照上述已知中的信息,以乙烯为原料(无机试剂任选),设计制备
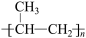 的路线。
的路线。【知识点】 有机物的合成 有机物的推断 根据题给物质选择合适合成路线解读
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:有机化学基础、化学与STSE、认识化学科学、化学反应原理、化学实验基础、物质结构与性质
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 蛋白质的变性 化学科学对人类文明发展的意义 | |
| 2 | 0.65 | 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 3 | 0.4 | 沉淀转化 物质性质实验方案的设计 | |
| 4 | 0.4 | 电解原理的应用 原电池、电解池综合考查 利用电子守恒法进行多池串联相关计算 | |
| 5 | 0.85 | 有机反应类型 同分异构体的数目的确定 乙烯 酯的水解反应机理 | |
| 6 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 | |
| 7 | 0.4 | 水的电离 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.4 | 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 9 | 0.4 | 探究物质组成或测量物质的含量 综合实验设计与评价 | 实验探究题 |
| 10 | 0.65 | 盖斯定律的应用 化学平衡的移动及其影响因素 化学平衡常数的有关计算 溶度积常数相关计算 | 原理综合题 |
| 11 | 0.65 | 物质结构与性质综合考查 电离能对物质某些性质的影响 杂化轨道理论理解 | 结构与性质 |
| 12 | 0.65 | 有机物的合成 有机物的推断 根据题给物质选择合适合成路线 | 有机推断题 |



