名校
1 . 在两份相同的Ba(OH)2溶液中,分别滴入相同浓度的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。(已知:相同体积、相同浓度的H2SO4、NaHSO4液中,H2SO4、NaHSO4的数量相同)
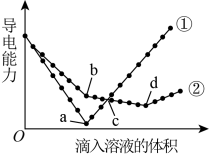
(1)图中①代表滴加哪种溶液的变化曲线___________ 。(填化学式)
(2)b点溶液中大量存在的离子是___________ 。
(3)a、d两点对应的溶液均显___________ (填“酸性”、“中性”、“碱性)
(4)曲线①中的a点导电能力最弱的原因是___________ 。(用化学方程式表示)
(5)c点两溶液中氢离子数量①___________ ②。(填大于,小于或等于)
(6)曲线②中的c点显___________ (填“酸性”、“中性”、“碱性”)
(7)曲线②中的b、d两点对应所加溶液的体积比为___________ 。

(1)图中①代表滴加哪种溶液的变化曲线
(2)b点溶液中大量存在的离子是
(3)a、d两点对应的溶液均显
(4)曲线①中的a点导电能力最弱的原因是
(5)c点两溶液中氢离子数量①
(6)曲线②中的c点显
(7)曲线②中的b、d两点对应所加溶液的体积比为
您最近一年使用:0次
名校
解题方法
2 . 下图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电的关系的装置图。
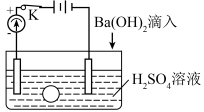
首先在水槽中加入200 mL 2 mol·L-1的H2SO4溶液,同时将一个表面光滑的小球放入溶液中,小球悬浮在溶液中央,闭合开关K,电流计发生偏转,然后再进行以下操作。请回答问题。
(1)向溶液中逐滴加入与H2SO4溶液密度相同的Ba(OH)2溶液至反应完全,观察到的现象是___________ ,反应的化学方程式是___________ ;
(2)将Ba(OH)2溶液换成浓度相同(假设密度也相同)的以下三种溶液(设反应后的体积为两溶液的体积和):
A.Ba(NO3)2 B.Na2SO4 C.Na2CO3
①滴加A的过程中,观察到的现象是___________ ,反应的化学方程式是___________ ;
②滴加B的过程中,小球的位置___________ ,电流计的偏转程度___________ ;
③滴加C的过程中,观察到的现象是___________ ,反应的化学方程式是___________ ,生成的Na2SO4的物质的量浓度为___________ 。

首先在水槽中加入200 mL 2 mol·L-1的H2SO4溶液,同时将一个表面光滑的小球放入溶液中,小球悬浮在溶液中央,闭合开关K,电流计发生偏转,然后再进行以下操作。请回答问题。
(1)向溶液中逐滴加入与H2SO4溶液密度相同的Ba(OH)2溶液至反应完全,观察到的现象是
(2)将Ba(OH)2溶液换成浓度相同(假设密度也相同)的以下三种溶液(设反应后的体积为两溶液的体积和):
A.Ba(NO3)2 B.Na2SO4 C.Na2CO3
①滴加A的过程中,观察到的现象是
②滴加B的过程中,小球的位置
③滴加C的过程中,观察到的现象是
您最近一年使用:0次
3 . 化学必修一人教版在检验氯离子时有如下操作:在三支试管中分别加入 稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象;再分别加入足量稀硝酸,观察现象。回答下列问题:
稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象;再分别加入足量稀硝酸,观察现象。回答下列问题:
(1)Na2CO3的电离方程式为___________ 。
(2)滴入AgNO3溶液后三种溶液中都能观察到的现象是___________ 。
(3)在盛Na2CO3溶液的试管中,滴入几滴AgNO3溶液后,再加入足量稀硝酸的离子方程式有___________ 。
(4)某实验室暂时无Na2CO3溶液,可用___________ (填化学式)与NaHCO3溶液反应制备Na2CO3溶液。
(5)现欲配制100 mL 0.6 mol/L NaCl溶液。
①使用托盘天平称量NaCl的质量为___________ g。
②在配制过程中,下列实验操作可能导致配制的NaCl溶液浓度偏高的是___________ (填序号)。
A.定容时俯视观察容量瓶刻度线
B.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
C.往容量瓶转移时,有少量液体溅出
D.转移溶液后未洗涤烧杯
 稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象;再分别加入足量稀硝酸,观察现象。回答下列问题:
稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象;再分别加入足量稀硝酸,观察现象。回答下列问题:(1)Na2CO3的电离方程式为
(2)滴入AgNO3溶液后三种溶液中都能观察到的现象是
(3)在盛Na2CO3溶液的试管中,滴入几滴AgNO3溶液后,再加入足量稀硝酸的离子方程式有
(4)某实验室暂时无Na2CO3溶液,可用
(5)现欲配制100 mL 0.6 mol/L NaCl溶液。
①使用托盘天平称量NaCl的质量为
②在配制过程中,下列实验操作可能导致配制的NaCl溶液浓度偏高的是
A.定容时俯视观察容量瓶刻度线
B.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
C.往容量瓶转移时,有少量液体溅出
D.转移溶液后未洗涤烧杯
您最近一年使用:0次
名校
4 . A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为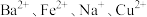 和
和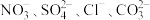 (离子在物质中不能重复出现)。
(离子在物质中不能重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,观察到C盐的溶液呈蓝色,且C盐固体中阴阳离子个数之比为 ;
;
②若向①的四支试管中分别加入足量稀盐酸,只有D的盐溶液有无色无味的气体逸出;
③向B盐溶液中加入硝酸酸化的 溶液,有白色沉淀产生;
溶液,有白色沉淀产生;
④A盐溶液与C盐溶液混合后有白色沉淀产生。
(1)根据以上实验事实可推断它们的化学式为:C___________ ;D___________ 。
(2)写出足量稀盐酸与D盐溶液反应放出气体的离子方程式:___________ 。
(3)向B盐与C盐的混合溶液中加入一定量的 粉,可能发生的反应有
粉,可能发生的反应有___________ (按照反应的先后顺序写出相应的离子方程式)。若加入 粉后,有金属析出,过滤、洗浲后向滤渣中加入稀盐酸,无气体产生,则滤液中一定含有的金属阳离子为
粉后,有金属析出,过滤、洗浲后向滤渣中加入稀盐酸,无气体产生,则滤液中一定含有的金属阳离子为___________ 。
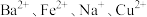 和
和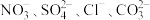 (离子在物质中不能重复出现)。
(离子在物质中不能重复出现)。①若把四种盐分别溶于盛有蒸馏水的四支试管中,观察到C盐的溶液呈蓝色,且C盐固体中阴阳离子个数之比为
 ;
;②若向①的四支试管中分别加入足量稀盐酸,只有D的盐溶液有无色无味的气体逸出;
③向B盐溶液中加入硝酸酸化的
 溶液,有白色沉淀产生;
溶液,有白色沉淀产生;④A盐溶液与C盐溶液混合后有白色沉淀产生。
(1)根据以上实验事实可推断它们的化学式为:C
(2)写出足量稀盐酸与D盐溶液反应放出气体的离子方程式:
(3)向B盐与C盐的混合溶液中加入一定量的
 粉,可能发生的反应有
粉,可能发生的反应有 粉后,有金属析出,过滤、洗浲后向滤渣中加入稀盐酸,无气体产生,则滤液中一定含有的金属阳离子为
粉后,有金属析出,过滤、洗浲后向滤渣中加入稀盐酸,无气体产生,则滤液中一定含有的金属阳离子为
您最近一年使用:0次
名校
5 . 离子反应与工农业生产、日常生活、科学实验有密切关系。
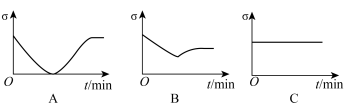
(1)一定温度下,向澄清石灰水中通入 至过量,其溶液的电导率(
至过量,其溶液的电导率( ,电导率越大,溶液导电能力越强)随反应时间(t)的变化图为
,电导率越大,溶液导电能力越强)随反应时间(t)的变化图为_______ (填字母)。
无色溶液甲可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 八种离子中的若干种。为确定甲溶液的组成,将其分成两等份,进行如下实验:
八种离子中的若干种。为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生有刺激性气味的气体,其在标准状况下的体积为4.48L。
②向另一份溶液中加入 溶液,产生白色沉淀,过滤,得到沉淀及滤液。
溶液,产生白色沉淀,过滤,得到沉淀及滤液。
③向上述沉淀中加入过量的盐酸,沉淀部分溶解。
④向上述滤液中加入硝酸酸化的 溶液,产生白色沉淀。
溶液,产生白色沉淀。
已知: 和
和 在加热条件下能生成
在加热条件下能生成 。
。
(2)上述实验①中产生气体的物质的量为_______ mol。
(3)实验③中发生反应的离子方程式为_______ 。
(4)甲溶液中一定不存在的离子是_______ (填离子符号,下同);可能存在的离子是_______ 。
(1)一定温度下,向澄清石灰水中通入
 至过量,其溶液的电导率(
至过量,其溶液的电导率( ,电导率越大,溶液导电能力越强)随反应时间(t)的变化图为
,电导率越大,溶液导电能力越强)随反应时间(t)的变化图为
无色溶液甲可能含有
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 八种离子中的若干种。为确定甲溶液的组成,将其分成两等份,进行如下实验:
八种离子中的若干种。为确定甲溶液的组成,将其分成两等份,进行如下实验:①向一份溶液中加入足量的NaOH浓溶液并加热,产生有刺激性气味的气体,其在标准状况下的体积为4.48L。
②向另一份溶液中加入
 溶液,产生白色沉淀,过滤,得到沉淀及滤液。
溶液,产生白色沉淀,过滤,得到沉淀及滤液。③向上述沉淀中加入过量的盐酸,沉淀部分溶解。
④向上述滤液中加入硝酸酸化的
 溶液,产生白色沉淀。
溶液,产生白色沉淀。已知:
 和
和 在加热条件下能生成
在加热条件下能生成 。
。(2)上述实验①中产生气体的物质的量为
(3)实验③中发生反应的离子方程式为
(4)甲溶液中一定不存在的离子是
您最近一年使用:0次
解题方法
6 . 七水合硫酸镁(MgSO4•7H2O)在印染、造纸等领域应用广泛。以化工废弃物盐泥(主要成分为MgCO3•CaCO3,含少量NaCl与含铁化合物)为原料可制取七水合硫酸镁,回答下列问题:
(1)称取干燥盐泥6.90g于100mL烧杯中,加入蒸馏水,缓慢滴加3.0mol•L-1H2SO4溶液,不断搅拌,得到酸解浆液,主要反应的化学方程式为________ ;配制3.0mol•L-1H2SO4溶液时,用到的实验仪器除烧杯、玻璃棒、量筒外,还必须使用的仪器有________ (填标号)。
A. B.
B.  C.
C.  D.
D.
(2)加热酸解浆液,在搅拌下补加盐泥,调节浆液的pH接近6,继续加热煮沸,趁热过滤,滤渣的主要成分是________ 、________ ,继续加热煮沸的目的是________ 。
(3)要证明铁元素已除尽,实验操作及现象是:________ 。
(4)向(2)所得滤液中加入6mol•L-1NaOH溶液至沉淀完全,过滤,该操作的目的是________ ,将滤渣完全溶于3.0mol•L-1H2SO4溶液,经如下实验操作:加热蒸发、________ 、过滤、洗涤、干燥,得到七水合硫酸镁。
(5)实验中制得七水合硫酸镁产品的质量为3.69g,则盐泥中MgCO3•CaCO3的含量为________ %,将产品加热至77℃,测得固体失重率为43.9%,该温度下固体的化学式为________ 。
(1)称取干燥盐泥6.90g于100mL烧杯中,加入蒸馏水,缓慢滴加3.0mol•L-1H2SO4溶液,不断搅拌,得到酸解浆液,主要反应的化学方程式为
A.
 B.
B.  C.
C.  D.
D.
(2)加热酸解浆液,在搅拌下补加盐泥,调节浆液的pH接近6,继续加热煮沸,趁热过滤,滤渣的主要成分是
(3)要证明铁元素已除尽,实验操作及现象是:
(4)向(2)所得滤液中加入6mol•L-1NaOH溶液至沉淀完全,过滤,该操作的目的是
(5)实验中制得七水合硫酸镁产品的质量为3.69g,则盐泥中MgCO3•CaCO3的含量为
您最近一年使用:0次
名校
解题方法
7 . 化学课堂上,同学们分小组合作探究碳酸钠的性质,请你参与探究并填空。
【实验记录与分析】
(1)
【反思与拓展】
(2)甲同学分析实验一得出:盐溶液__________ (选填“一定”或“不一定”)显中性。
(3)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有__________ 。
(4)丙同学对比实验三和实验四的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是__________ 。
【实验记录与分析】
(1)
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 实验操作 |  |  |  |  |
| 实验现象 | 溶液由无色变为红色 | 生成白色沉淀 | 生成白色沉淀 | |
| 实验结论 | 碳酸钠溶液显 | 碳酸钠能与盐酸发生反应 | 碳酸钠能与氢氧化钙发生反应 |
【反思与拓展】
(2)甲同学分析实验一得出:盐溶液
(3)乙同学用稀硫酸代替实验二中的稀盐酸进行探究,发现实验现象相同。从微观角度分析,这是因为稀盐酸和稀硫酸中都含有
(4)丙同学对比实验三和实验四的现象,从微观角度分析,两个反应的实质相同,溶液中相互结合的离子都是
您最近一年使用:0次
8 . 某实验小组同学在实验活动中对溶液的酸碱性进行检验,分别检验以下溶液的酸碱性:a.稀盐酸b.稀硫酸c.氢氧化钠溶液d.澄清石灰水e.氯化钠溶液f.碳酸钠溶液。
(1)在该实验中检验溶液的酸碱性,最合适的是___________ (填标号)。
A.pH试纸 B.无色酚酞溶液 C.紫色石蕊溶液
(2)该组同学在活动中发现溶液酸碱性规律:酸溶液呈酸性,碱溶液呈碱性,盐溶液中氯化钠溶液呈中性,而碳酸钠溶液呈碱性。
对 溶液呈碱性的原因产生分歧:
溶液呈碱性的原因产生分歧:
猜想一: 溶液自身呈碱性
溶液自身呈碱性
猜想二: 溶液中混有NaOH
溶液中混有NaOH
进一步设计实验来探究:在以上 溶液中加入足量的
溶液中加入足量的 溶液(经检验
溶液(经检验 溶液呈中性),充分反应后再检测溶液的酸碱性。实验结果溶液呈中性,则
溶液呈中性),充分反应后再检测溶液的酸碱性。实验结果溶液呈中性,则___________ (填“猜想一”或“猜想二”)成立。
(3)请你对盐溶液的酸碱性进行评价:___________ 。
(1)在该实验中检验溶液的酸碱性,最合适的是
A.pH试纸 B.无色酚酞溶液 C.紫色石蕊溶液
(2)该组同学在活动中发现溶液酸碱性规律:酸溶液呈酸性,碱溶液呈碱性,盐溶液中氯化钠溶液呈中性,而碳酸钠溶液呈碱性。
对
 溶液呈碱性的原因产生分歧:
溶液呈碱性的原因产生分歧:猜想一:
 溶液自身呈碱性
溶液自身呈碱性猜想二:
 溶液中混有NaOH
溶液中混有NaOH进一步设计实验来探究:在以上
 溶液中加入足量的
溶液中加入足量的 溶液(经检验
溶液(经检验 溶液呈中性),充分反应后再检测溶液的酸碱性。实验结果溶液呈中性,则
溶液呈中性),充分反应后再检测溶液的酸碱性。实验结果溶液呈中性,则(3)请你对盐溶液的酸碱性进行评价:
您最近一年使用:0次
9 . 某化学小组甲同学学习了酸、碱、盐化学性质后展开了如下探究活动:
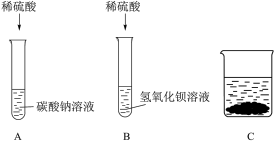
(1)B试管中发生反应的离子方程式为____________________ 。
(2)【实验一】A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图所示;

据此判断B试管中反应后所得溶液中的溶质是___________ (填化学式)。
(3)【实验二】将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到___________ 的实验现象,进而证明滤渣为混合物;
(4)【猜想与假设】实验二C烧杯的滤液中含有哪些离子?
猜想一:Na+、Ba2+、OH-
猜想二:Na+、H+、CO
猜想三:Na+、OH-、CO
猜想四:Na+、OH-、SO
猜想五:___________ (写出一种即可);
小组同学一致认为猜想___________ 不正确,理由是___________________ 。

(1)B试管中发生反应的离子方程式为
(2)【实验一】A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图所示;

据此判断B试管中反应后所得溶液中的溶质是
(3)【实验二】将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到
(4)【猜想与假设】实验二C烧杯的滤液中含有哪些离子?
猜想一:Na+、Ba2+、OH-
猜想二:Na+、H+、CO

猜想三:Na+、OH-、CO

猜想四:Na+、OH-、SO

猜想五:
小组同学一致认为猜想
您最近一年使用:0次
解题方法
10 . 某工业废水中可能含有 、
、 、
、 、
、 、
、 中的几种离子,为确定废水组成设计以下实验:
中的几种离子,为确定废水组成设计以下实验:
①取0.1L废水滴加足量氢氧化钠溶液,生成沉淀0.04mol;
②另取0.1L废水滴加足量氯化钡溶液,生成白色沉淀6.99g,再加入足量稀盐酸无明显变化。
回答下列问题:
(1)溶液中一定没有的离子是___________ 。
(2)溶液中可能含有的离子是___________ 。
(3)步骤①中产生沉淀的成分是___________ (用化学式表示);步骤②中加入氯化钡溶液发生反应的离子方程式是___________ 。
(4)溶液中一定含有的离子是___________ ;其中离子的物质的量一定能确定的离子是___________ 。
 、
、 、
、 、
、 、
、 中的几种离子,为确定废水组成设计以下实验:
中的几种离子,为确定废水组成设计以下实验:①取0.1L废水滴加足量氢氧化钠溶液,生成沉淀0.04mol;
②另取0.1L废水滴加足量氯化钡溶液,生成白色沉淀6.99g,再加入足量稀盐酸无明显变化。
回答下列问题:
(1)溶液中一定没有的离子是
(2)溶液中可能含有的离子是
(3)步骤①中产生沉淀的成分是
(4)溶液中一定含有的离子是
您最近一年使用:0次



