真题
名校
1 . 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:
3S+6KOH 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
K2Sx(x=2~6)
S+ K2SO3 K2S2O3
K2S2O3
请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=______ 。
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=______ 。(写出计算过程)
3S+6KOH
 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O(x-1)S+K2S
 K2Sx(x=2~6)
K2Sx(x=2~6)S+ K2SO3
 K2S2O3
K2S2O3请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=
您最近一年使用:0次
2021-01-09更新
|
4076次组卷
|
12卷引用:2021年1月新高考浙江化学高考真题
2021年1月新高考浙江化学高考真题(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题(已下线)专题18.化学计算-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年1月浙江高考化学试题变式题26-31(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试化学(学考)试题(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)浙江省宁波市鄞州中学(宁波鄞州蓝青高级中学)2023-2024学年高一上学期12月月考化学学科试题
名校
解题方法
2 . 某合金(仅含铜、铁)中铜和铁的物质的量之和为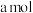 ,其中
,其中 的物质的量分数为b,将其全部投入
的物质的量分数为b,将其全部投入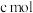 的稀硝酸中,加热使其充分反应(假设
的稀硝酸中,加热使其充分反应(假设 是唯一的还原产物)。
是唯一的还原产物)。
(1)若产生标准状况下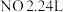 ,则反应转移电子的物质的量为
,则反应转移电子的物质的量为________________ 
(2)若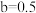 ,溶液中的
,溶液中的 与
与 的物质的量之比
的物质的量之比 ,标准状况下产生
,标准状况下产生 ,
,
___ 
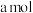 ,其中
,其中 的物质的量分数为b,将其全部投入
的物质的量分数为b,将其全部投入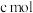 的稀硝酸中,加热使其充分反应(假设
的稀硝酸中,加热使其充分反应(假设 是唯一的还原产物)。
是唯一的还原产物)。(1)若产生标准状况下
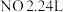 ,则反应转移电子的物质的量为
,则反应转移电子的物质的量为
(2)若
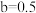 ,溶液中的
,溶液中的 与
与 的物质的量之比
的物质的量之比 ,标准状况下产生
,标准状况下产生 ,
,

您最近一年使用:0次
2022-06-17更新
|
1387次组卷
|
3卷引用:浙江省浙江大学附属中学2021-2022学年高三下学期5月份仿真模拟化学试题
浙江省浙江大学附属中学2021-2022学年高三下学期5月份仿真模拟化学试题 浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题(已下线)【知识图鉴】单元讲练测必修第二册第五单元 03巩固练
3 . 请回答下列问题:
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为_______
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为_______
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为_______
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为_______
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是_______
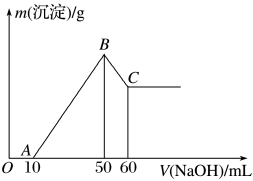
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为_______
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为

您最近一年使用:0次
2022-04-04更新
|
1297次组卷
|
3卷引用:江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题
江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题(已下线)专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题
4 . 向27.2gCu和Cu2O的固体混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成4.48LNO(标准状况)和Cu(NO3)2,在所得溶液中加入1.0mol•L-1的NaOH溶液1.0L,此时溶液中的溶质为NaNO3,铜离子已完全沉淀,沉淀质量为39.2g。(提示:Cu2O稀硝酸反应的方程式为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O)
(1)在上述Cu2O与硝酸的反应中,硝酸表现出的性质有______ 。
(2)计算原固体混合物Cu2O中Cu与的物质的量之比_____ 。
(3)计算原硝酸溶液的物质的量浓度_____ 。
(1)在上述Cu2O与硝酸的反应中,硝酸表现出的性质有
(2)计算原固体混合物Cu2O中Cu与的物质的量之比
(3)计算原硝酸溶液的物质的量浓度
您最近一年使用:0次
2023-05-05更新
|
780次组卷
|
3卷引用:浙江省长河中学2022-2023学年高一下学期期中考试化学试题
浙江省长河中学2022-2023学年高一下学期期中考试化学试题 (已下线)【2023】【高一下】【期中考】【长河】【高中化学】【刘尼尼收集】山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题
名校
解题方法
5 . 将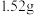 铜镁合金完全溶解于
铜镁合金完全溶解于 的浓硝酸中,得到
的浓硝酸中,得到 和
和 的混合气体
的混合气体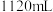 (标准状况),向反应后的溶液中加入
(标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
(1) 的浓硝酸中含有
的浓硝酸中含有 的物质的量为
的物质的量为_______  。
。
(2)该合金含铜_______ g。
(3)混合气体中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
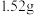 铜镁合金完全溶解于
铜镁合金完全溶解于 的浓硝酸中,得到
的浓硝酸中,得到 和
和 的混合气体
的混合气体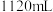 (标准状况),向反应后的溶液中加入
(标准状况),向反应后的溶液中加入 溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:
溶液,当金属离子全部沉淀时,得到2.54g沉淀。求:(1)
 的浓硝酸中含有
的浓硝酸中含有 的物质的量为
的物质的量为 。
。(2)该合金含铜
(3)混合气体中,
 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2022-06-24更新
|
1629次组卷
|
2卷引用:浙江省湖州市2021-2022学年高一下学期期末考试化学试题
名校
解题方法
6 . 完成下列问题。
(1)已知完全断裂物质的量均为1mol的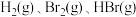 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为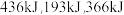 。则在该条件下,
。则在该条件下,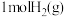 与
与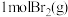 完全反应会
完全反应会_______ (填“吸收”或“放出”)_______  能量。
能量。
(2)将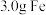 和
和 的混合粉末完全溶于
的混合粉末完全溶于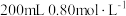 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:
①则混合粉末中Fe的物质的量是_______ mol;
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是_______ g。
(1)已知完全断裂物质的量均为1mol的
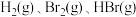 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为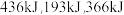 。则在该条件下,
。则在该条件下,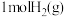 与
与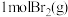 完全反应会
完全反应会 能量。
能量。(2)将
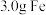 和
和 的混合粉末完全溶于
的混合粉末完全溶于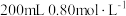 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:①则混合粉末中Fe的物质的量是
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是
您最近一年使用:0次
7 . 将一定量 通入
通入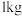 质量分数为
质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:
(1) 溶液中
溶液中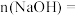
___________  。
。
(2)已知混合溶液中 ,则混合溶液中
,则混合溶液中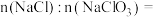
___________ 。
(3)所通 在标准状况下的体积为
在标准状况下的体积为___________ L。
 通入
通入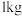 质量分数为
质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:(1)
 溶液中
溶液中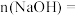
 。
。(2)已知混合溶液中
 ,则混合溶液中
,则混合溶液中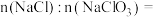
(3)所通
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
2022-05-04更新
|
903次组卷
|
4卷引用:浙江省杭州地区(含周边)重点中学2021-2022学年高一下学期期中考试化学试题
解题方法
8 . 铜镁合金恰好完全溶解于 一定浓度的硝酸中,得到
一定浓度的硝酸中,得到 和
和 的混合气体
的混合气体 (标准状况),将这些气体与
(标准状况),将这些气体与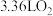 (标准状况)混合后通入
(标准状况)混合后通入 溶液,所有气体被完全吸收生成硝酸钠。计算:
溶液,所有气体被完全吸收生成硝酸钠。计算:
(1)混合气体中 与
与 的物质的量之比为
的物质的量之比为_______ 。(写出计算过程)
(2)硝酸的物质的量浓度为_______ 。
 一定浓度的硝酸中,得到
一定浓度的硝酸中,得到 和
和 的混合气体
的混合气体 (标准状况),将这些气体与
(标准状况),将这些气体与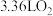 (标准状况)混合后通入
(标准状况)混合后通入 溶液,所有气体被完全吸收生成硝酸钠。计算:
溶液,所有气体被完全吸收生成硝酸钠。计算:(1)混合气体中
 与
与 的物质的量之比为
的物质的量之比为(2)硝酸的物质的量浓度为
您最近一年使用:0次
9 .  在不同温度下失水和分解,随着温度升高分别生成
在不同温度下失水和分解,随着温度升高分别生成 ,现称取
,现称取 在敞口容器加热一定时间后,得到
在敞口容器加热一定时间后,得到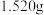 固体,测得生成的
固体,测得生成的 的体积为
的体积为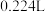 (已折算为标准标况),求:
(已折算为标准标况),求:
(1)固体的成分和物质的量比_______ 。
(2)标准状态下生成 的体积
的体积_______ 。
 在不同温度下失水和分解,随着温度升高分别生成
在不同温度下失水和分解,随着温度升高分别生成 ,现称取
,现称取 在敞口容器加热一定时间后,得到
在敞口容器加热一定时间后,得到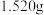 固体,测得生成的
固体,测得生成的 的体积为
的体积为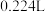 (已折算为标准标况),求:
(已折算为标准标况),求:(1)固体的成分和物质的量比
(2)标准状态下生成
 的体积
的体积
您最近一年使用:0次
名校
解题方法
10 . 在标准状况下将3.84g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气1.12L (标况)。
(1)Cu的物质的量是__ mol。
(2)反应消耗HNO3的物质的量__ mol。
(3)NO2和NO的体积比为__ 。
(1)Cu的物质的量是
(2)反应消耗HNO3的物质的量
(3)NO2和NO的体积比为
您最近一年使用:0次
2021-06-30更新
|
1609次组卷
|
2卷引用:浙江省绍兴市诸暨市2020-2021学年高一下学期期末考试化学试题



