解题方法
1 . 某学习小组同学探究FeSO4的化学性质和用途。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)
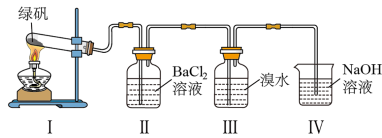
(1)II中有白色沉淀生成,说明FeSO4固体分解生成了_____________ 。
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为_________________ ,实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是______________ 。
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式___________ 。
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。
(三)硫酸亚铁用途探究
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是_______________________ 。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)

(1)II中有白色沉淀生成,说明FeSO4固体分解生成了
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。
| 实验步骤 | 实验预期现象和结论 |
| 步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |  |
| 步骤二:滴加 | 当溶液中出现 |
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是
您最近一年使用:0次
2 . 锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是_____________ 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③_________________ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是_________ ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是_____________ 。
(5)步骤Ⅳ中,在_____ (填“阴”或“阳”)极析出Mn,电极反应方程式为_________ 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥_____ mol·L-1。

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是
(4)步骤Ⅲ中,滤渣2的主要成分是
(5)步骤Ⅳ中,在
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥
您最近一年使用:0次
3 . 26.铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式_______________ ;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因_____________________ 。
(3)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式____________________ 。
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
_____ Cu2S+_____ HNO3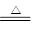
_____ CuSO4 + _____ Cu(NO3)2+_____ NO↑+ _____
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为_______ (填化学式)。
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因
(3)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为
您最近一年使用:0次
4 . 元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是_______ ;
24.碘元素在元素周期表中的位置是_________________ ;为防缺碘,食盐中常添加碘酸钾,该物质内存在____________________ 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是________ ;液溴的保存通常采取的方法是__________ 。
26.通过比较___________ 或________________ 可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:

①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O □NaClO3+ □
□NaClO3+ □__________________
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是__________________ 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________ 。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是
24.碘元素在元素周期表中的位置是
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是
26.通过比较
27.工业上,通过如下转化可制得KClO3晶体:

①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O
 □NaClO3+ □
□NaClO3+ □②II反应过程能析出KClO3晶体而无其它晶体析出的原因是
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是
您最近一年使用:0次
11-12高三上·四川攀枝花·阶段练习
5 . 2010年8月7日甘肃舟曲发生特大泥石流灾害,专家指出,为防止大灾过后瘟疫发生,可用含氯消毒剂和过氧化物对环境消毒。
(1)气体二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:_______
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3•3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只作氧化剂的是_______ (填序号)。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温下于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是_______ 。
(4)物质的标准生成热是指由稳定的单质生成1mol指定物质时的热效应。如H2O(l)的生成热为-285.8 kJ•mol-1,用热化学方程式表示为 H2(g)+1/2O2(g)=H2O(l);△H= -285.8 kJ•mol-1。查表知ClO2的标准生成热是+102.5kJ•mol-1,则该反应用热化学方程式表示为_______ 。
(1)气体二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3•3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只作氧化剂的是
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温下于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是
(4)物质的标准生成热是指由稳定的单质生成1mol指定物质时的热效应。如H2O(l)的生成热为-285.8 kJ•mol-1,用热化学方程式表示为 H2(g)+1/2O2(g)=H2O(l);△H= -285.8 kJ•mol-1。查表知ClO2的标准生成热是+102.5kJ•mol-1,则该反应用热化学方程式表示为
您最近一年使用:0次



