解题方法
1 . 含氯消毒剂在生产生活中有着广泛的用途。
(1)①写出实验室中制取氯气的离子方程式:_____________________ 。
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
15.8gKMnO4能氧化_______ molHCl,产生的Cl2在标准状况下的体积为_____ L。
(2)常温下,氯气与烧碱溶液反应得84消毒液,NaClO是84消毒液的有效成分,在抗击新型冠状病毒中发挥了重要作用。浸泡衣物时加入84消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示:____________________________ (已知酸性:H2CO3>HClO> )。
)。
(3)某温度下,将aL(已换算成标况体积)氯气通入由24gNaOH配成的溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1:3。
的个数比为1:3。
①a=______ L;
②写出该反应的化学方程式:______________________________ 。
(1)①写出实验室中制取氯气的离子方程式:
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
15.8gKMnO4能氧化
(2)常温下,氯气与烧碱溶液反应得84消毒液,NaClO是84消毒液的有效成分,在抗击新型冠状病毒中发挥了重要作用。浸泡衣物时加入84消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示:
 )。
)。(3)某温度下,将aL(已换算成标况体积)氯气通入由24gNaOH配成的溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与
 的个数比为1:3。
的个数比为1:3。①a=
②写出该反应的化学方程式:
您最近一年使用:0次
2 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______ _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) ___________
若反应生成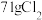 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: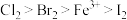 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: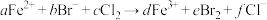 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①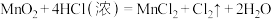
②
③
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
 _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) 若反应生成
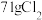 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
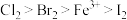 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: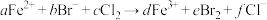 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
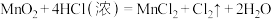
②

③

④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近一年使用:0次
2023-10-11更新
|
799次组卷
|
3卷引用:湖北武汉市第六中学2023-2024学年高一上学期10月月考化学试题
2024高三下·全国·专题练习
解题方法
3 . 偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.12%)还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:

“除杂”过程加入双氧水的目的是___________ (用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于1×10-6 mol·L-1,在室温下需调节pH的范围是:___________ (已知:Ksp[Fe(OH)3]=1×10-39,Ksp[Al(OH)3]=1×10-33,pH=9.3时,Mg2+开始沉淀)。

“除杂”过程加入双氧水的目的是
您最近一年使用:0次
4 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即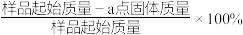 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①
②
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即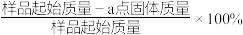 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为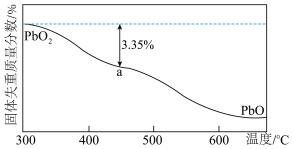
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①

②

上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次
5 . 元素化合物在化工生产和环境科学中有着重要的用途。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为____ 、____ 、____ 。
(2)自然界中Cr主要以+3价和+6价形式存在。 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:____ 。
(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:____ 。
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+____ Br- (填“>”或“<”)。
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈____ 色,写出该反应的离子方程式____ 。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为
(2)自然界中Cr主要以+3价和+6价形式存在。
 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈
您最近一年使用:0次
解题方法
6 . 磷是一种重要的元素。回答下列问题:
(1)磷的氢化物在空气中能自燃,写出磷的最简单氢化物的电子式:_______ ,白磷也能自燃且有剧毒, 溶液可作白磷中毒的内服解毒剂,请配平该反应的化学方程式:
溶液可作白磷中毒的内服解毒剂,请配平该反应的化学方程式:________
_______ _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(2)次磷酸( )是一种精细磷化工产品,在工业生产中有广泛的用途。已知6.6 g
)是一种精细磷化工产品,在工业生产中有广泛的用途。已知6.6 g  最多可中和100 mL 1mol·L
最多可中和100 mL 1mol·L NaOH溶液,则次磷酸中磷的化合价为
NaOH溶液,则次磷酸中磷的化合价为_______ 价,它是_______ 元酸。利用 和
和 溶液在酸性条件下进行化学镀银的反应中,氧化产物与还原产物的物质的量之比为1:4,写出相应的离子方程式:
溶液在酸性条件下进行化学镀银的反应中,氧化产物与还原产物的物质的量之比为1:4,写出相应的离子方程式:_______ 。
(3)已知 是二元酸,常温下电离常数分别为0.01、
是二元酸,常温下电离常数分别为0.01、 。
。
① 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为_______ ,下列对 的分类中错误的是
的分类中错误的是_______ (填字母)。
A.酸式盐 B.正盐 C.钠盐 D.磷酸盐
②亚磷酸可使酸性 溶液褪色,该反应生成
溶液褪色,该反应生成 和
和 的离子方程式为
的离子方程式为_______ 。
③常温下, ,则
,则 与足量
与足量 溶液混合反应时,消耗的酸与盐的物质的量之比为
溶液混合反应时,消耗的酸与盐的物质的量之比为_______ 。
(1)磷的氢化物在空气中能自燃,写出磷的最简单氢化物的电子式:
 溶液可作白磷中毒的内服解毒剂,请配平该反应的化学方程式:
溶液可作白磷中毒的内服解毒剂,请配平该反应的化学方程式:_______
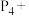 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(2)次磷酸(
 )是一种精细磷化工产品,在工业生产中有广泛的用途。已知6.6 g
)是一种精细磷化工产品,在工业生产中有广泛的用途。已知6.6 g  最多可中和100 mL 1mol·L
最多可中和100 mL 1mol·L NaOH溶液,则次磷酸中磷的化合价为
NaOH溶液,则次磷酸中磷的化合价为 和
和 溶液在酸性条件下进行化学镀银的反应中,氧化产物与还原产物的物质的量之比为1:4,写出相应的离子方程式:
溶液在酸性条件下进行化学镀银的反应中,氧化产物与还原产物的物质的量之比为1:4,写出相应的离子方程式:(3)已知
 是二元酸,常温下电离常数分别为0.01、
是二元酸,常温下电离常数分别为0.01、 。
。①
 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为 的分类中错误的是
的分类中错误的是A.酸式盐 B.正盐 C.钠盐 D.磷酸盐
②亚磷酸可使酸性
 溶液褪色,该反应生成
溶液褪色,该反应生成 和
和 的离子方程式为
的离子方程式为③常温下,
 ,则
,则 与足量
与足量 溶液混合反应时,消耗的酸与盐的物质的量之比为
溶液混合反应时,消耗的酸与盐的物质的量之比为
您最近一年使用:0次
7 . 氧化还原反应在工业生产、环保及科研中有广泛的应用,请根据以上信息,结合自己所掌握的化学知识,回答下列问题:
I.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(1)写出CuH在氯气中燃烧的化学反应方程式:___________ 。
(2)CuH溶解在稀盐酸中生成的气体是___________ (填化学式)。
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:___________ 。
II.钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:
(4)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是______ 。
(5)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式。____ +_____VO2++_____=______Cl-+______VO
+_____VO2++_____=______Cl-+______VO +_____,
+_____,___________ 。
(6)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是 ___________ 。
I.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(1)写出CuH在氯气中燃烧的化学反应方程式:
(2)CuH溶解在稀盐酸中生成的气体是
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:
II.钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:
(4)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是
(5)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式。____
 +_____VO2++_____=______Cl-+______VO
+_____VO2++_____=______Cl-+______VO +_____,
+_____,(6)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则
 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是
您最近一年使用:0次
8 . 铬及其化合物在工业上有重要的用途。铬元素的化合价可以是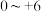 的整数价态。请根据如下转化关系图回答问题:
的整数价态。请根据如下转化关系图回答问题:
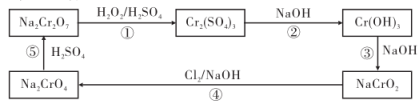
(1)框图中的含铬化合物中,铬元素为 价的盐有
价的盐有___________ 。
(2)反应①中氧化剂与还原剂的物质的量之比为___________ 。
(3)根据反应②、③,知 类似
类似 具有两性,请写出
具有两性,请写出 的酸式电离方程式:
的酸式电离方程式:___________ 。
(4)反应④的离子方程式为___________ 。
(5)目前处理酸性 废水多采用铁氧磁体法。该法是向废水中加入
废水多采用铁氧磁体法。该法是向废水中加入 将
将 还原成
还原成 ,调节
,调节 ,
, 、
、 全部转化成相当于
全部转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理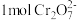 ,需加入
,需加入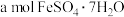 ,下列有关结论正确的是___________。
,下列有关结论正确的是___________。
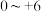 的整数价态。请根据如下转化关系图回答问题:
的整数价态。请根据如下转化关系图回答问题:
(1)框图中的含铬化合物中,铬元素为
 价的盐有
价的盐有(2)反应①中氧化剂与还原剂的物质的量之比为
(3)根据反应②、③,知
 类似
类似 具有两性,请写出
具有两性,请写出 的酸式电离方程式:
的酸式电离方程式:(4)反应④的离子方程式为
(5)目前处理酸性
 废水多采用铁氧磁体法。该法是向废水中加入
废水多采用铁氧磁体法。该法是向废水中加入 将
将 还原成
还原成 ,调节
,调节 ,
, 、
、 全部转化成相当于
全部转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理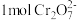 ,需加入
,需加入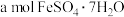 ,下列有关结论正确的是___________。
,下列有关结论正确的是___________。A.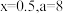 | B.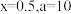 |
C.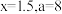 | D. |
您最近一年使用:0次
名校
解题方法
9 . I.摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
(1)Si在元素周期表中的位置是_______ 。
(2)根据用途推测SiO2在水中的溶解性:_______ (填“易溶”或“难溶”)。
(3)制备SiO2的方法如图:
Na2SiO3溶液 H2SiO3沉淀
H2SiO3沉淀 SiO2
SiO2
①写出反应I的离子方程式_______ 。
②比较酸性强弱:H2SO4_______ H2SiO3(填“>”或“<”)。
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。

下列说法正确的是_______ (填序号)。
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
II.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
(1)K2FeO4中铁元素的化合价为_______ 。
(2)制备K2FeO4需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于K2FeO4的说法中,不正确 的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整: 4K2FeO4 + H2O = Fe(OH)3(胶体)+_____ + KOH
______
(5)消毒净化500 m3水,至少需要K2FeO4的质量为_______ kg。
(1)Si在元素周期表中的位置是
(2)根据用途推测SiO2在水中的溶解性:
(3)制备SiO2的方法如图:
Na2SiO3溶液
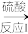 H2SiO3沉淀
H2SiO3沉淀 SiO2
SiO2①写出反应I的离子方程式
②比较酸性强弱:H2SO4
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。

下列说法正确的是
a.Sn元素的最高正化合价为+4
b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料
II.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
| 【化学式】K2FeO4 【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1 L水投放5 mg K2FeO4即可达到卫生标准 |
(2)制备K2FeO4需要在
(3)下列关于K2FeO4的说法中,
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整: 4K2FeO4 + H2O = Fe(OH)3(胶体)+_____ + KOH
(5)消毒净化500 m3水,至少需要K2FeO4的质量为
您最近一年使用:0次
名校
10 . 硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)已知硼既能与酸又能与碱反应,化学性质类似于铝,请写出硼与氢氧化钠反应的化学方程式___ ;
(2)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构____________ (填“相同”或“不相同”)。
②B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为_______ L。
(3)已知H3BO3是一种白色片状晶体,微溶于水,它的的电离类似于Al(OH)3,可用于制备储氢材料NaBH4涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①H3BO3为____ (填“一元”、“二元”或“三元”)酸
②B(OCH3)3属于_____ (填序号)类。
A.烃 B.醇 C.酯 D.羧酸
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为__ 。
(1)已知硼既能与酸又能与碱反应,化学性质类似于铝,请写出硼与氢氧化钠反应的化学方程式
(2)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构
②B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为
(3)已知H3BO3是一种白色片状晶体,微溶于水,它的的电离类似于Al(OH)3,可用于制备储氢材料NaBH4涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①H3BO3为
②B(OCH3)3属于
A.烃 B.醇 C.酯 D.羧酸
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为
您最近一年使用:0次



