1 . IBr、ICl、BrF3等称之为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(1)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是____________________ 。
(2)溴化碘(IBr)具有强氧化性,能与Na2SO3溶液发生反应,发生反应的离子方程式为______________________________________________________________ ;
(3)①已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。现将几滴KSCN溶液滴入到含少量Fe3+的溶液中,溶液立即变红,向其中逐滴滴入酸性KMnO4溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象____________________________ ;
② 下列物质中,也可以使该溶液红色褪去的是_________ ;
A.新制氯水 B.碘水 C.SO2 D.盐酸
(4)KCN为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将CN-氧化为CO32-和一种单质气体,该反应的离子方程式为________________ ;
(5)已知HCN的电离平衡常数K=6.2×10-10,H2CO3的 电离平衡常数K1=4.5×10-7,K2=4.7×10-11,则下列离子方程式能发生的是_________ 。
A.CN-+CO2+H2O═HCN+HCO3- B.2HCN+CO32-=2CN-+CO2↑+H2O
C.2CN-+CO2+H2O═HCN+CO32- D.HCN+CO32-=CN-+HCO3-
(1)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是
(2)溴化碘(IBr)具有强氧化性,能与Na2SO3溶液发生反应,发生反应的离子方程式为
(3)①已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。现将几滴KSCN溶液滴入到含少量Fe3+的溶液中,溶液立即变红,向其中逐滴滴入酸性KMnO4溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
② 下列物质中,也可以使该溶液红色褪去的是
A.新制氯水 B.碘水 C.SO2 D.盐酸
(4)KCN为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将CN-氧化为CO32-和一种单质气体,该反应的离子方程式为
(5)已知HCN的电离平衡常数K=6.2×10-10,H2CO3的 电离平衡常数K1=4.5×10-7,K2=4.7×10-11,则下列离子方程式能发生的是
A.CN-+CO2+H2O═HCN+HCO3- B.2HCN+CO32-=2CN-+CO2↑+H2O
C.2CN-+CO2+H2O═HCN+CO32- D.HCN+CO32-=CN-+HCO3-
您最近一年使用:0次
名校
2 . 由我国自主研发的“奋斗者号”潜水艇在太平洋马里亚纳海沟成功坐底,创造了中国载人深潜的新纪录。
(1)过氧化钠可用作潜水艇的供氧剂,Na2O2中阳离子与阴离子的个数之比为___________ ;写出Na2O2和CO2反应的化学方程式:___________ ,该反应中生成一个O2时,转移的___________ 个电子。
(2)将一定量的Na2O2固体投入到含有下列离子的溶液中:Cl-、HCO 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(3)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:补全方程式并配平。_______
___________MnO +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________
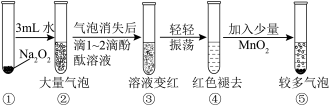
(4)某实验小组通过如图所示实验,探究Na2O2与水的反应,下列说法正确的是___________。
(5)查阅资料知:Na2O2在一定条件下可以转化为NaNO2,NaNO2易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知NaNO2能发生如下反应: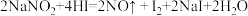 ,上述反应中氧化剂是
,上述反应中氧化剂是___________ ,氧化产物是___________ ,HI在反应中体现了___________ 性。
②根据上述反应鉴别NaNO2和NaCl。可选用的物质有___________ (填序号)。
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
(1)过氧化钠可用作潜水艇的供氧剂,Na2O2中阳离子与阴离子的个数之比为
(2)将一定量的Na2O2固体投入到含有下列离子的溶液中:Cl-、HCO
 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(3)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:补全方程式并配平。
___________MnO
 +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________(4)某实验小组通过如图所示实验,探究Na2O2与水的反应,下列说法正确的是___________。

| A.②中的大量气泡主要成分是氢气 |
| B.③中溶液变红,说明有酸性物质生成 |
| C.④中现象可能是由于溶液中含有强氧化性物质造成的 |
| D.⑤中MnO2的主要作用是验证溶液中存在过氧化氢 |
(5)查阅资料知:Na2O2在一定条件下可以转化为NaNO2,NaNO2易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知NaNO2能发生如下反应:
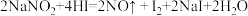 ,上述反应中氧化剂是
,上述反应中氧化剂是②根据上述反应鉴别NaNO2和NaCl。可选用的物质有
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
您最近一年使用:0次
名校
解题方法
3 . 含氯消毒剂会与水中有机物发生氯代反应,生成物会在人体内积留产生慢性累积中毒,诱发癌症,而 ClO2 是国际上公认的最理想的更换替代产品,我国从2000年起就逐渐用它取代了其它含氯消毒剂。市面上销售的二氧化氯消毒片都是二氧化氯的前体:亚氯酸钠,亚氯酸钠溶液与酸、有机物、还原剂或者氯供体接触,将会发生反应生成二氧化氯气体。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为___________ 。
(2)此反应中氧化剂与还原剂的物质的量之比为____ ,反应中盐酸的作用是____ (填编号)。
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为______ 。
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目______ ,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是______ 。
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是_______ 。
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式_________ 。
(7)饮用水中的ClO2、 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
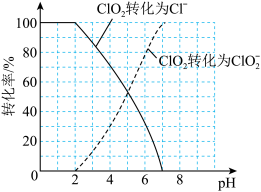
①请写出pH≤2.0时 与I-反应的离子方程式:
与I-反应的离子方程式:_________ 。
②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:_____ ,溶液再次显蓝色;
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中 的浓度为
的浓度为_______ mol/L(用含字母的代数式表示)。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为
(2)此反应中氧化剂与还原剂的物质的量之比为
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
| A.2NaSCN+MnO2+2H2SO4=Na2SO4+(SCN)2↑+MnSO4+2H2O |
| B.(CN)2+2KI=2KCN+I2 |
| C.Cl2+2NaOCN= (OCN)2+2NaCl |
| D.2AgCN=2Ag+(CN)2 |
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的
 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式(7)饮用水中的ClO2、
 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
①请写出pH≤2.0时
 与I-反应的离子方程式:
与I-反应的离子方程式:②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中
 的浓度为
的浓度为
您最近一年使用:0次
4 . 亚硝酸钠易溶于水,水溶液显碱性,有氧化性,也有还原性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+____
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:_____
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是__ 。从环保角度来讲,要处理NaNO2,所用的物质的___ (填“氧化性”或“还原性”)应该比KI更__ (填“强”或“弱”)。
(4)简便鉴别亚硝酸钠和氯化钠的方法是____ 。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。___
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
(4)简便鉴别亚硝酸钠和氯化钠的方法是
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。
您最近一年使用:0次
2019-09-17更新
|
2975次组卷
|
7卷引用:第一章 章末检测(2)《高中新教材同步备课》(人教版 必修第一册)
名校
5 . 亚硫酸盐是一类很早即在世界范围内广泛使用的食品添加剂,可作为食品漂白剂,防腐剂;可抑制非酶褐变和酶促褐变,防止食品褐变,使水果不至黑变,还能防止鲜虾生成黑斑;在酸性介质中,还是十分有效的抗菌剂。
(1)亚硫酸钠中,阴离子的空间结构为___________ 。
(2)常温下, 溶液呈碱性,原因是
溶液呈碱性,原因是___________ (用离子方程式表示)。
(3)常温下,已知 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
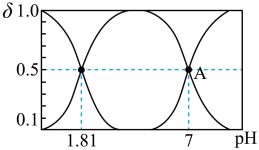
①A点溶液中离子浓度大小关系为___________ 。
②常温下, 溶液呈
溶液呈___________ 性。
(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是___________ (用离子方程式表示)。常温处理后,再调节 使
使 浓度不高于
浓度不高于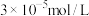 即可排放,调节
即可排放,调节 应不低于
应不低于___________ 。[已知Ksp[Cr(OH)3]=3×10-32]
(1)亚硫酸钠中,阴离子的空间结构为
(2)常温下,
 溶液呈碱性,原因是
溶液呈碱性,原因是(3)常温下,已知
 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
①A点溶液中离子浓度大小关系为
②常温下,
 溶液呈
溶液呈(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性
 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是 使
使 浓度不高于
浓度不高于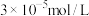 即可排放,调节
即可排放,调节 应不低于
应不低于
您最近一年使用:0次
6 . 化学工业为疫情防控提供了强有力的物质支撑。NaClO是生活中高效、广谱的灭菌消毒剂,它的一种制备方法是向NaOH溶液中通入Cl2,主要产物为NaClO和NaCl。回答下列问题:
(1)氯原子的结构示意图为_______ ,NaClO的电子式为_______ 。
(2)已知:Cl2+NaOH→NaCl+NaClO+H2O(未配平),该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)NaClO溶液不能与洁厕灵共混的原因是_______ (用离子方程式表示)。
(4)上述反应的产物中可能还含有NaClO3,为了验证NaClO3和NaClO的氧化能力,某实验兴趣小组分别取少量的NaClO3和NaClO标准液置于1号和2号试管中,向两试管中分别滴加等量且适量的中性NaI溶液。1号试管中溶液颜色不变。2号试管中溶液颜色变为棕色,加入CCl4振荡,静置后CCl4层显_______ 色。可知该条件下,NaClO3的氧化能力_______ (填“大于”或“小于”)NaClO。
(5)上述反应中所用的氯气的制备方法之一为HCl(浓)+KMnO4→KCl+MnCl2+Cl2↑+H2O(未配平)。
①该反应主要体现了HCl(浓)的_______ (填“酸性”、“氧化性”、“还原性”、“易挥发性”或“腐蚀性”)。
②标准状况下,该反应中,每生成4.48LCl2时,转移的电子数为_______ NA。
(1)氯原子的结构示意图为
(2)已知:Cl2+NaOH→NaCl+NaClO+H2O(未配平),该反应中氧化剂与还原剂的物质的量之比为
(3)NaClO溶液不能与洁厕灵共混的原因是
(4)上述反应的产物中可能还含有NaClO3,为了验证NaClO3和NaClO的氧化能力,某实验兴趣小组分别取少量的NaClO3和NaClO标准液置于1号和2号试管中,向两试管中分别滴加等量且适量的中性NaI溶液。1号试管中溶液颜色不变。2号试管中溶液颜色变为棕色,加入CCl4振荡,静置后CCl4层显
(5)上述反应中所用的氯气的制备方法之一为HCl(浓)+KMnO4→KCl+MnCl2+Cl2↑+H2O(未配平)。
①该反应主要体现了HCl(浓)的
②标准状况下,该反应中,每生成4.48LCl2时,转移的电子数为
您最近一年使用:0次
名校
7 . 氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______ kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________ 。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________ ;为抑制肼的分解,可采取的合理措施有________ (任写一种)。
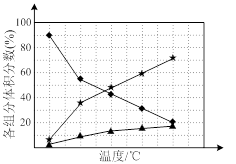
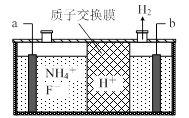
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________ 。
② a电极为电解池的_____________ (填“阴”或“阳”)极,写出该电极的电极反应式:________________ ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________ 。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:


图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为
② a电极为电解池的
您最近一年使用:0次
2016-01-21更新
|
369次组卷
|
3卷引用:2015届江苏省南通、扬州、连云港高三第二次调研测试化学试卷
解题方法
8 . 从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。 以下是氯元素形成物质的二维图的部分信息。

(1)根据图中信息,写出任意两种氯的含氧酸的化学式_____ 、_____ 。
(2)写出 NaOH 溶液吸收 Cl2的离子方程式_____ 。
(3)实验室常用高锰酸钾固体与浓盐酸在常温下反应来快速制备少量氯气。反应方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①浓盐酸在上述反应中显示_____ (填写序号)。
A 只有还原性 B 只有氧化性
C 既有氧化性又有酸性 D 既有还原性又有酸性
②当反应过程中有 6.02×1022个电子发生转移时,生成 Cl2的体积为_____ (在标 准状况下),被氧化的 HCl 的物质的量为_____ 。
(4)潮湿的 Cl2与 Na2CO3混合制取少量 Cl2O 的反应中,Cl2既体现了氧化性,也体现了还原性,且生成2种盐。写出反应的化学方程式,并用双线桥标出电子转移的方向和数目_____ 。

(1)根据图中信息,写出任意两种氯的含氧酸的化学式
(2)写出 NaOH 溶液吸收 Cl2的离子方程式
(3)实验室常用高锰酸钾固体与浓盐酸在常温下反应来快速制备少量氯气。反应方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①浓盐酸在上述反应中显示
A 只有还原性 B 只有氧化性
C 既有氧化性又有酸性 D 既有还原性又有酸性
②当反应过程中有 6.02×1022个电子发生转移时,生成 Cl2的体积为
(4)潮湿的 Cl2与 Na2CO3混合制取少量 Cl2O 的反应中,Cl2既体现了氧化性,也体现了还原性,且生成2种盐。写出反应的化学方程式,并用双线桥标出电子转移的方向和数目
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为___________ mol。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。___________
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。
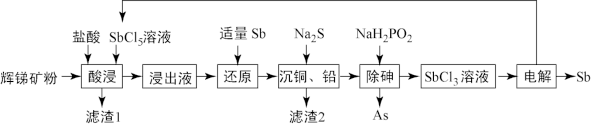
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是___________ (填化学式)。
(5)写出“还原”反应的化学方程式___________ 。
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 序号 | 实验 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是
(5)写出“还原”反应的化学方程式
您最近一年使用:0次
2021-07-28更新
|
1110次组卷
|
3卷引用:吉林省长春希望高中2020-2021学年高二下学期期末考试化学试题
名校
10 . 化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为___________ ;
(2)物质氧化性和还原性的强弱是相对的。已知氧化性:KMnO4(H+)>H2O2>Fe2+,分别写出KMnO4(H+)与H2O2混合,酸性环境下H2O2与FeCl2混合的离子方程式:_________ 、_______ 。
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:________________ 、_________________ 。
(4)向含有n mol溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式:_____ 。
(5)向NH4Al(SO4)2中加Ba(OH)2,二者以物质的量比为4:9混合,请写出离子方程式:______ 。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为
(2)物质氧化性和还原性的强弱是相对的。已知氧化性:KMnO4(H+)>H2O2>Fe2+,分别写出KMnO4(H+)与H2O2混合,酸性环境下H2O2与FeCl2混合的离子方程式:
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:
(4)向含有n mol溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式:
(5)向NH4Al(SO4)2中加Ba(OH)2,二者以物质的量比为4:9混合,请写出离子方程式:
您最近一年使用:0次



