名校
解题方法
1 . 元素化合物知识在化工生产和生活中发挥着重要作用,根据教材知识和题中所给资料完成下列各题
资料Ⅰ:铬元素的常见价态有+6、+3、+2价。在酸性介质中,+6价铬在酸性条件下以 存在,具有强氧化性,在碱性介质中以
存在,具有强氧化性,在碱性介质中以 存在。
存在。
资料Ⅱ:锰元素的常见价态有+7、+6、+4、+3、+2价,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
①在酸性介质中, 具有强氧化性,本身被还原为Mn2+。
具有强氧化性,本身被还原为Mn2+。
②在碱性、中性或微弱酸性溶液中, 仍旧是氧化剂,本身被还原为MnO2。
仍旧是氧化剂,本身被还原为MnO2。
资料Ⅲ:硫代硫酸钠: 俗名海波或大苏打,易溶于水,溶于水后呈碱性。
俗名海波或大苏打,易溶于水,溶于水后呈碱性。
S元素的化合价为+2价,具有还原性,遇酸不稳定发生歧化反应。
过二硫酸钠Na2S2O8中S元素的化合价是+6价,Na2S2O8是一种强氧化剂。
(1)写出Cr3+在酸性环境中被强氧化剂PbO2氧化的离子反应方程式___________ ,写出在碱性溶液中,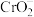 可以被H2O2氧化为离子反应方程式
可以被H2O2氧化为离子反应方程式___________ 。
(2)写出向高锰酸钾溶液中滴加H2C2O4溶液的离子反应方程式___________ 。
(3)写出Na2S2O3与盐酸反应的化学方程式___________ 。
(4)1个Na2S2O8中化合价为-2价的氧原子有___________ 个,其阴离子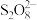 结构中含有
结构中含有___________ 个过氧键(—O—O—)。
资料Ⅰ:铬元素的常见价态有+6、+3、+2价。在酸性介质中,+6价铬在酸性条件下以
 存在,具有强氧化性,在碱性介质中以
存在,具有强氧化性,在碱性介质中以 存在。
存在。资料Ⅱ:锰元素的常见价态有+7、+6、+4、+3、+2价,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
①在酸性介质中,
 具有强氧化性,本身被还原为Mn2+。
具有强氧化性,本身被还原为Mn2+。②在碱性、中性或微弱酸性溶液中,
 仍旧是氧化剂,本身被还原为MnO2。
仍旧是氧化剂,本身被还原为MnO2。资料Ⅲ:硫代硫酸钠:
 俗名海波或大苏打,易溶于水,溶于水后呈碱性。
俗名海波或大苏打,易溶于水,溶于水后呈碱性。S元素的化合价为+2价,具有还原性,遇酸不稳定发生歧化反应。
过二硫酸钠Na2S2O8中S元素的化合价是+6价,Na2S2O8是一种强氧化剂。
(1)写出Cr3+在酸性环境中被强氧化剂PbO2氧化的离子反应方程式
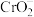 可以被H2O2氧化为离子反应方程式
可以被H2O2氧化为离子反应方程式(2)写出向高锰酸钾溶液中滴加H2C2O4溶液的离子反应方程式
(3)写出Na2S2O3与盐酸反应的化学方程式
(4)1个Na2S2O8中化合价为-2价的氧原子有
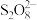 结构中含有
结构中含有
您最近半年使用:0次
名校
2 . 某实验小组欲通过加热蒸发硝酸钾( )溶液的方法获得
)溶液的方法获得 固体。已知
固体。已知 固体在一定温度下能发生反应:
固体在一定温度下能发生反应: 。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(
。为了探究加热蒸发所得固体X中是否含有亚硝酸钾( ),小组同学设计并完成了以下实验。
),小组同学设计并完成了以下实验。
【查阅资料】
ⅰ.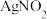 是微溶于水的白色(略带黄色)固体
是微溶于水的白色(略带黄色)固体
ⅱ. 、
、 能在酸性条件下与
能在酸性条件下与 反应,生成
反应,生成
【实验过程】
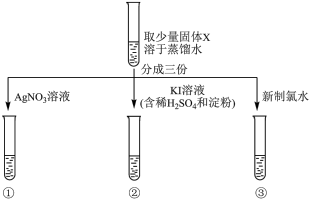
【分析解释】
(1)在 反应中,
反应中, 和
和 属于
属于___________ (填“酸”或“碱”或“盐”)。
(2)N的原子结构示意图为___________ 。从化合价的角度预测, 具有的性质是
具有的性质是___________ (填“氧化性”或“还原性”或“既有氧化性,又有还原性”)。
(3)实验①中,观察到有少量白色沉淀生成,该白色沉淀是___________
(4)实验②中,观察到的现象是___________
(5)实验③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响。补齐该反应的离子方程式。__________
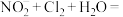 □___________
□___________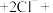 □___________。
□___________。
【反思评价】
(6)综合上述实验,甲同学得出以下结论。你认为甲同学所得结论正确的是___________
a.从试管②中的现象可得出酸性条件下,氧化性: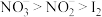
b.试管①、③中的实验现象均可以证明固体X中含有
 )溶液的方法获得
)溶液的方法获得 固体。已知
固体。已知 固体在一定温度下能发生反应:
固体在一定温度下能发生反应: 。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(
。为了探究加热蒸发所得固体X中是否含有亚硝酸钾( ),小组同学设计并完成了以下实验。
),小组同学设计并完成了以下实验。【查阅资料】
ⅰ.
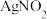 是微溶于水的白色(略带黄色)固体
是微溶于水的白色(略带黄色)固体ⅱ.
 、
、 能在酸性条件下与
能在酸性条件下与 反应,生成
反应,生成
【实验过程】

【分析解释】
(1)在
 反应中,
反应中, 和
和 属于
属于(2)N的原子结构示意图为
 具有的性质是
具有的性质是(3)实验①中,观察到有少量白色沉淀生成,该白色沉淀是
(4)实验②中,观察到的现象是
(5)实验③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响。补齐该反应的离子方程式。
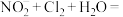 □___________
□___________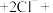 □___________。
□___________。【反思评价】
(6)综合上述实验,甲同学得出以下结论。你认为甲同学所得结论正确的是
a.从试管②中的现象可得出酸性条件下,氧化性:
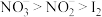
b.试管①、③中的实验现象均可以证明固体X中含有

您最近半年使用:0次
3 . 含氯、含钠化合物在生活、生产中随处可见。回答下列问题:
(1)某同学查询资料,发现用氯气消毒的自来水不能直接用于浇灌植物、养鱼等。
①不能直接用于浇灌植物、养鱼的原因是氯的水溶液具有较强的___________ (填“氧化性”或“还原性”)
②可以采取___________ 方式快速除水中的氯,再用于浇灌植物。
A.阳光下暴晒 B.烧开后冷却 C.加入过量 固体
固体
(2) 不方便运输,储存,通常将其制备为次氯酸盐。如工业上可用氯气与冷的石灰乳反应制备漂白粉,发生反应的化学方程式为
不方便运输,储存,通常将其制备为次氯酸盐。如工业上可用氯气与冷的石灰乳反应制备漂白粉,发生反应的化学方程式为___________ 。
(3)碱性条件下, 氧化
氧化 可制备绿色消毒剂
可制备绿色消毒剂 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(4)为了使以面粉为原料制作的面包松软可口,通常用碳酸氢钠作发泡剂,发泡时发生的化学方程式为___________ 。
(1)某同学查询资料,发现用氯气消毒的自来水不能直接用于浇灌植物、养鱼等。
①不能直接用于浇灌植物、养鱼的原因是氯的水溶液具有较强的
②可以采取
A.阳光下暴晒 B.烧开后冷却 C.加入过量
 固体
固体(2)
 不方便运输,储存,通常将其制备为次氯酸盐。如工业上可用氯气与冷的石灰乳反应制备漂白粉,发生反应的化学方程式为
不方便运输,储存,通常将其制备为次氯酸盐。如工业上可用氯气与冷的石灰乳反应制备漂白粉,发生反应的化学方程式为(3)碱性条件下,
 氧化
氧化 可制备绿色消毒剂
可制备绿色消毒剂 ,该反应的离子方程式为
,该反应的离子方程式为(4)为了使以面粉为原料制作的面包松软可口,通常用碳酸氢钠作发泡剂,发泡时发生的化学方程式为
您最近半年使用:0次
解题方法
4 . 铅(Pb)及其化合物广泛用于冶金、蓄电池、印刷、颜料、油漆等领域,常见铅的化合物主要以+2价和+4价的形态存在。经查阅资料:
已知:①Pb与酸反应都得到+2价的化合物。
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因___________ 。
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式___________ 。
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和 ,反应的离子方程式为
,反应的离子方程式为 ___________ ,该反应说明PbO2具有 ___________ (填“氧化性”或“还原性”)。
(4)经查阅,PbO2是两性氧化物,设计实验并验证
| 物质 | PbO | PbO2 | PbCl2 | PbCl+4 |
| 在水中的溶解性(常温) | 难溶于水的黄色固体 | 难溶于水的棕黑色固体 | 微溶于水的白色固体 | 易溶于水的黄色油状液体 |
| 物质 | PbSO4 | Pb(NO3)2 | Na2PbO2 | Na2PbO3 |
| 在水中的溶解性(常温) | 难溶于水的白色固体 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 |
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和
 ,反应的离子方程式为
,反应的离子方程式为 (4)经查阅,PbO2是两性氧化物,设计实验并验证
| 实验步骤 | 实验现象 | 反应的化学方程式 |
| ①向盛有PbO2固体的试管中滴加NaOH溶液 | 棕黑色固体逐渐溶解 | |
| ②向盛有PbO2固体的试管中滴加稀盐酸 |
您最近半年使用:0次
解题方法
5 . 亚硝酸钠(NaNO2)有毒、有咸味,外形与食盐相似,人若误食会引起中毒。某兴趣小组欲研究亚硝酸钠,查阅资料得到如表信息。试根据信息回答下列问题:
(1)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,则该反应中氧化剂是 _______ ;若有0.75mol电子发生转移,则被氧化的还原剂的粒子数为 _______ (用NA表示阿伏加德罗常数的值)。
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
(3)下列方法中,可用来区分NaNO2和NaCl的是 _______ (填序号)。
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_______ 。
| 药品 | NaNO2(亚硝酸钠) |
| 性质 | 在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+。 |
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
| A.NaNO2被还原 |
| B.维生素C具有还原性 |
| C.还原性:维生素C>Fe2+ |
| D.NaNO2是还原剂 |
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式
您最近半年使用:0次
6 . 双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。某学习小组设计一组与双氧水相关的实验如表所示:
请回答下列问题:
(1)实验Ⅰ的离子方程式为_____________________________ ;该原理广泛用于除去Fe3+中的Fe2+的操作中,此操作的优点是__________ 。
(2)实验Ⅱ可用于测定双氧水的浓度,用酸性高锰酸钾溶液滴定双氧水,达到滴定终点的标志是________ ,反应的离子方程式为_________________________ 。当有1.7g过氧化氢参加反应时转移的电子数目为_____________ 。
(3)在实验Ⅲ和Ⅳ中双氧水没有表现的性质是________ (填选项字母)。
A.氧化性 B.还原性 C.不稳定性 D.酸性
(4)双氧水能将碱性废水中的CN-转化成碳酸盐和一种使湿润的红色石蕊试纸变蓝的气体,写出反应的离子方程式________________________________________ 。
| 实验 | 实验操作与现象 |
| Ⅰ | 向含少量硫酸亚铁的硫酸铁溶液中滴加双氧水和稀硫酸 |
| Ⅱ | 向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去 |
| Ⅲ | 向淀粉-KI溶液中滴加双氧水,溶液变蓝色 |
| Ⅳ | 向双氧水加入铁红粉末,产生大量气泡 |
请回答下列问题:
(1)实验Ⅰ的离子方程式为
(2)实验Ⅱ可用于测定双氧水的浓度,用酸性高锰酸钾溶液滴定双氧水,达到滴定终点的标志是
(3)在实验Ⅲ和Ⅳ中双氧水没有表现的性质是
A.氧化性 B.还原性 C.不稳定性 D.酸性
(4)双氧水能将碱性废水中的CN-转化成碳酸盐和一种使湿润的红色石蕊试纸变蓝的气体,写出反应的离子方程式
您最近半年使用:0次
名校
解题方法
7 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
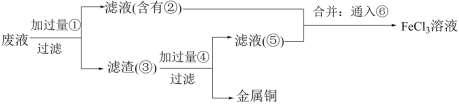
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
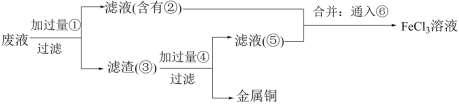
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近半年使用:0次
2022-04-05更新
|
406次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第一中学2021--2022学年高一上学期期末考试化学试题
8 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。
①关于二氧化氯的说法不正确 的是______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。
①ClO2的氧化性______ H2O2的氧化性(填“大于”或“小于”)。
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为___________ 。
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是___________ 。
②整个吸收SO2过程中作氧化剂的微粒有___________ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。①关于二氧化氯的说法
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
 (未配平)。
(未配平)。①ClO2的氧化性
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是
②整个吸收SO2过程中作氧化剂的微粒有
您最近半年使用:0次
名校
9 . 回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为: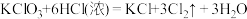 。
。
(1)请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
(2)反应中,氧化剂为___________ ,氧化产物为:___________ 。
(3)浓盐酸在反应中体现出来的性质有___________ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为 ,该反应中还原剂是
,该反应中还原剂是___________ 。(填化学式)
(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1个 转移
转移___________ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:
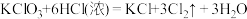 。
。(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)反应中,氧化剂为
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为
 ,该反应中还原剂是
,该反应中还原剂是(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个
 转移
转移
您最近半年使用:0次
10 . KMnO4具有强氧化性,实验室可用其与浓盐酸反应制备氯气。
(1)配平下列有关反应的化学方程式____ ,___KMnO4+___HCl(浓)= __MnCl2 +__ KCl+___Cl2↑+__H2O。
(2)反应中,氧化剂是________ (填化学式,下同),氧化产物是________ 。元素化合价升高的元素是________ ,氧化剂与还原剂的个数之比为_______ 。
(3)盐酸在上述反应中体现出的性质有_______ (填序号)
①氧化性 ②还原性 ③碱性 ④酸性
(4)湿法制备高铁酸钾( K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、 、Cl-、H2O,写出该反应的离子方程式:
、Cl-、H2O,写出该反应的离子方程式:_______ 。
(1)配平下列有关反应的化学方程式
(2)反应中,氧化剂是
(3)盐酸在上述反应中体现出的性质有
①氧化性 ②还原性 ③碱性 ④酸性
(4)湿法制备高铁酸钾( K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O,写出该反应的离子方程式:
、Cl-、H2O,写出该反应的离子方程式:
您最近半年使用:0次



