名校
1 . 硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)浓硝酸具有以下性质:
①强氧化性 ②酸性 ③还原性 ④不稳定性 ⑤挥发性
下列反应或者现象主要体现了硝酸的什么性质:
①久置浓硝酸显黄色___________ (填序号,下同)。
②用稀硝酸清洗试管壁上的银___________ 。
③稀硝酸清洗石灰水试剂瓶壁上的固体___________ 。
(2)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目___________ 。
(3)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是___________ (填字母代号)。
A.0.5mol B.1.0mol C.2.0mol D.3.0mol
(4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念:“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是___________ (填字母代号)。
A.Cu Cu(NO3)2
Cu(NO3)2
B.Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
C.Cu CuO
CuO Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2
D.Cu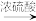 CuSO4
CuSO4  Cu(NO3)2
Cu(NO3)2
(5)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。写出该反应的化学方程式________ ,当生成a mol硝酸锌时,被还原的硝酸的物质的量为________ 。
(1)浓硝酸具有以下性质:
①强氧化性 ②酸性 ③还原性 ④不稳定性 ⑤挥发性
下列反应或者现象主要体现了硝酸的什么性质:
①久置浓硝酸显黄色
②用稀硝酸清洗试管壁上的银
③稀硝酸清洗石灰水试剂瓶壁上的固体
(2)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目
(3)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是
A.0.5mol B.1.0mol C.2.0mol D.3.0mol
(4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念:“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是
A.Cu
 Cu(NO3)2
Cu(NO3)2B.Cu
 CuO
CuO Cu(NO3)2
Cu(NO3)2C.Cu
 CuO
CuO Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2D.Cu
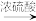 CuSO4
CuSO4  Cu(NO3)2
Cu(NO3)2 (5)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。写出该反应的化学方程式
您最近一年使用:0次
2 . 三氧化砷,俗称砒霜,分子式As2O3,是最具商业价值的砷化合物及主要的砷化学开始物料。它也是最古老的毒物之一,无臭无味,外观为白色霜状粉末,故称砒霜。
(1)完成并配平下列化学方程式:___ As2O3+___ Zn+___ H2SO4→___ AsH3+___ ZnSO4+___
(2)As2O3在上述反应中显示出来的性质是___ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.2molAsH3,则转移电子的物质的量为___ mol。
(4)砷化氢AsH3是一种很强的还原性,在室温下它能在空气中自然,其氧化产物是砒霜,写出该反应的化学方程式___ 。
(1)完成并配平下列化学方程式:
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.2molAsH3,则转移电子的物质的量为
(4)砷化氢AsH3是一种很强的还原性,在室温下它能在空气中自然,其氧化产物是砒霜,写出该反应的化学方程式
您最近一年使用:0次
2020-03-21更新
|
335次组卷
|
4卷引用:2015届陕西省渭南市高三教学质量检测(一模)化学试卷
2015届陕西省渭南市高三教学质量检测(一模)化学试卷上海市六校联考2015-2016学年高三上学期期中考试化学试题沪科版化学拓展性课程4《离子互换反应和氧化还原反应》测试题(已下线)专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
解题方法
3 . KClO3和浓盐酸在一定温度下反应会生成红黄色的易爆物二氧化氯。
(1)请完成该过程的化学方程式并配平。
____ KClO3+___ HCl(浓)===____ KCl+____ ClO2↑+____ Cl2↑+___ ( )
(2)浓盐酸在反应中显示出来的性质是__ (填写编号)。
①氧化性 ②还原性 ③酸性 ④碱性
(3)若反应生成0.1molCl2,则转移的电子数为__ 。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)1kgClO2相当于___ kgCl2。(提示:Cl2和ClO2在消毒过程中均变为Cl-)
(1)请完成该过程的化学方程式并配平。
(2)浓盐酸在反应中显示出来的性质是
①氧化性 ②还原性 ③酸性 ④碱性
(3)若反应生成0.1molCl2,则转移的电子数为
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)1kgClO2相当于
您最近一年使用:0次
4 . (1)5 mol的CO2与8 mol的SO2的分子数之比是________ ;原子数之比是________ ;质量比是________ 。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:________ KClO3+________HCl(浓)===________KCl+________ClO2↑+________Cl2↑+________H2O
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的________ (填“氧化”或“还原”)产物。浓盐酸在反应中显示出来的性质是(填写号码)________ 。
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为________ mol。
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的________ 倍(保留2位小数)。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的
您最近一年使用:0次
名校
解题方法
5 . 高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。
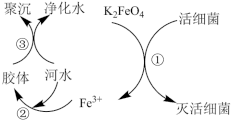
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)过程①中活性菌表现了_______ (填“氧化”或“还原”)性;过程③属于______ (填“物理”或“化学”)变化。
(3)根据上述原理分析,作水处理剂时, 的作用有
的作用有________ 、_________ (填两个)。
(4)制备高铁酸钾常用的反应原理为 (未配平)。
(未配平)。
①通过该反应说明:在碱性条件下,氧化性:
_______ (填“>”、“=”或“<”) 。
。
②配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:_______ 。

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)过程①中活性菌表现了
(3)根据上述原理分析,作水处理剂时,
 的作用有
的作用有(4)制备高铁酸钾常用的反应原理为
 (未配平)。
(未配平)。①通过该反应说明:在碱性条件下,氧化性:

 。
。②配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:
您最近一年使用:0次
2022-12-17更新
|
163次组卷
|
2卷引用:浙江省平湖市当湖高级中学2022-2023学年高一上学期12月阶段测试化学试题
21-22高一下·上海浦东新·阶段练习
6 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
___________ ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________ ___________
___________ ___________
___________ ___________
___________
(1)请完成该化学方程式并配平。___________
(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:___________
 ___________KI+___________=___________NO↑+___________
___________KI+___________=___________NO↑+___________ ___________
___________ ___________
___________ ___________
___________
(1)请完成该化学方程式并配平。
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.离子化合物 g.共价化合物
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是___________(填序号)。
和NaCl的是___________(填序号)。| A.分别溶于水 |
B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 |
| D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C.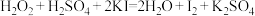 |
D. |
您最近一年使用:0次
7 . 亚硝酸钠( )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。
(1)已知 能发生如下反应:
能发生如下反应: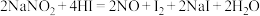 。用双线桥标出该反应的电子转移方向和数目:
。用双线桥标出该反应的电子转移方向和数目:___________ 。
(2)
___________ (填“是”或“不是”)电解质,根据 中N的化合价是
中N的化合价是___________ ,推测 具有
具有___________ (填“氧化性”、“还原性”或“氧化性和还原性”)。
(3)实验操作如表所示,请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。
③通过上述实验可知, 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_____________ 。
④写出实验3中发生反应的化学方程式:___________ 。
 )是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究
)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究 的性质。
的性质。(1)已知
 能发生如下反应:
能发生如下反应: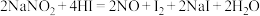 。用双线桥标出该反应的电子转移方向和数目:
。用双线桥标出该反应的电子转移方向和数目:(2)

 中N的化合价是
中N的化合价是 具有
具有(3)实验操作如表所示,请完善表格中的实验现象和结论(已知
 遇淀粉变蓝)。
遇淀粉变蓝)。| 实验 | 实验操作及现象或结果 | 结论 |
| 1 | 取 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |  具有① 具有① |
| 2 | 取 溶液(先酸化好)于试管中,滴加足量的 溶液(先酸化好)于试管中,滴加足量的 溶液,可观察到的实验现象为② 溶液,可观察到的实验现象为② |  具有还原性 具有还原性 |
| 3 |  固体与70%硫酸反应生成了NO和 固体与70%硫酸反应生成了NO和 两种气体 两种气体 |  具有氧化性和还原性 具有氧化性和还原性 |
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为④写出实验3中发生反应的化学方程式:
您最近一年使用:0次
2023-06-08更新
|
346次组卷
|
2卷引用:广东省梅州市五华县田家炳中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
8 . 含氯消毒剂会与水中有机物发生氯代反应,生成物会在人体内积留产生慢性累积中毒,诱发癌症,而 ClO2 是国际上公认的最理想的更换替代产品,我国从2000年起就逐渐用它取代了其它含氯消毒剂。市面上销售的二氧化氯消毒片都是二氧化氯的前体:亚氯酸钠,亚氯酸钠溶液与酸、有机物、还原剂或者氯供体接触,将会发生反应生成二氧化氯气体。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为___________ 。
(2)此反应中氧化剂与还原剂的物质的量之比为____ ,反应中盐酸的作用是____ (填编号)。
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为______ 。
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目______ ,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是______ 。
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是_______ 。
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式_________ 。
(7)饮用水中的ClO2、 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
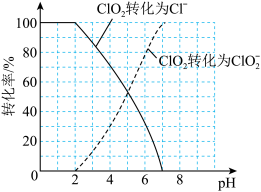
①请写出pH≤2.0时 与I-反应的离子方程式:
与I-反应的离子方程式:_________ 。
②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:_____ ,溶液再次显蓝色;
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中 的浓度为
的浓度为_______ mol/L(用含字母的代数式表示)。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为
(2)此反应中氧化剂与还原剂的物质的量之比为
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
| A.2NaSCN+MnO2+2H2SO4=Na2SO4+(SCN)2↑+MnSO4+2H2O |
| B.(CN)2+2KI=2KCN+I2 |
| C.Cl2+2NaOCN= (OCN)2+2NaCl |
| D.2AgCN=2Ag+(CN)2 |
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的
 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式(7)饮用水中的ClO2、
 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
①请写出pH≤2.0时
 与I-反应的离子方程式:
与I-反应的离子方程式:②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中
 的浓度为
的浓度为
您最近一年使用:0次
名校
9 . 根据所学知识,回答下列问题:
(1)下表是对一些物质进行分类
其中 Na2O2中O____ 价,它____ 碱性氧化物(填“是”或“不是”)
(2)过氧化钠水溶液中加入几滴紫色石蕊试液,现象:___________ ,写出过氧化钠与水反应的离子方程式:___________ 。
(3)实验室氯气不能排放在空气中,可用氢氧化钠溶液处理,其原因是:__________ 。氯气通入到⑥的溶液中的离子方程式:___________ 。
(4)如何要检验某溶液中是否含有钾元素,可以用操作方法:___________ 。
(5)实验室通过反应KMnO4+HCl(浓)—MnCl2+KCl+Cl2↑+H2O(未配平)制备氯气,反应中氯化氢表现出的性质是_____ 。(填写字母)
a.还原性 b.酸性 c.氧化性
请配平该反应,并用双线桥标电子转移的方向和数目:___________ 。
(1)下表是对一些物质进行分类
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 单质 |
| 化学式 | ①H2SO4 ②HCl | ③NaOH ④Ba(OH)2 | ⑤NaHCO3 ⑥NaI | ⑦CO2 ⑧Na2O2 | ⑨O2 ⑩Cl2 |
(2)过氧化钠水溶液中加入几滴紫色石蕊试液,现象:
(3)实验室氯气不能排放在空气中,可用氢氧化钠溶液处理,其原因是:
(4)如何要检验某溶液中是否含有钾元素,可以用操作方法:
(5)实验室通过反应KMnO4+HCl(浓)—MnCl2+KCl+Cl2↑+H2O(未配平)制备氯气,反应中氯化氢表现出的性质是
a.还原性 b.酸性 c.氧化性
请配平该反应,并用双线桥标电子转移的方向和数目:
您最近一年使用:0次
10 . 亚硝酸钠易溶于水,水溶液显碱性,有氧化性,也有还原性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+____
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:_____
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是__ 。从环保角度来讲,要处理NaNO2,所用的物质的___ (填“氧化性”或“还原性”)应该比KI更__ (填“强”或“弱”)。
(4)简便鉴别亚硝酸钠和氯化钠的方法是____ 。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。___
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
(4)简便鉴别亚硝酸钠和氯化钠的方法是
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。
您最近一年使用:0次
2019-09-17更新
|
2975次组卷
|
7卷引用:第一章 章末检测(2)《高中新教材同步备课》(人教版 必修第一册)



