1 . 饮用水质量是关系人类健康的重要问题。
(1)Cl2是最早用于饮用水消毒的物质,写出Cl2溶于水发生反应的离子方程式:___ 。
(2)ClO2是一种高效、低毒的消毒剂,逐渐取代Cl2成为生产自来水的消毒剂,工业上用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应中氧化剂与还原剂物质的量之比为____ 。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、ClO2氧化性更强,是无二次污染的绿色水处理剂。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。由以上信息可知,相同条件下,高铁酸钠溶解度比高铁酸钾溶解度__ (填“大”或“小”)。高铁酸钾溶于水放出氧气,能杀菌消毒,生成能吸附水中悬浮物的氢氧化铁胶体。用一个离子方程式表示高铁酸钾处理水的过程____ 。干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应的还原剂是___ ,每生成1molNa2FeO4转移__ mol电子。
(1)Cl2是最早用于饮用水消毒的物质,写出Cl2溶于水发生反应的离子方程式:
(2)ClO2是一种高效、低毒的消毒剂,逐渐取代Cl2成为生产自来水的消毒剂,工业上用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应中氧化剂与还原剂物质的量之比为
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、ClO2氧化性更强,是无二次污染的绿色水处理剂。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。由以上信息可知,相同条件下,高铁酸钠溶解度比高铁酸钾溶解度
您最近一年使用:0次
2019-10-31更新
|
220次组卷
|
2卷引用:山东省日照市2018-2019学年高一上学期期末模块考试化学试题
名校
解题方法
2 . (1)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。化学镀镍的溶液中含有Ni2+和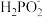 ,在酸性条件下发生以下镀镍反应:Ni2++
,在酸性条件下发生以下镀镍反应:Ni2++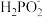 +=Ni+
+=Ni+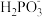 +。
+。
①请完成并配平上述方程式_____ 。
②上述反应中,若生成1 mol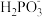 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为_____ 。
(2)①高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,若生成2 mol Na2FeO4,则反应中电子转移的物质的量为____ mol。
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+1 mg的水体样本,需要1.2 mg·L-1高铁酸钾____ L。
(3)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL 5mol/L盐酸中,再加入一定量铁粉恰好溶解,收集到2.24 L(标准状况)气体,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为____ 。
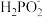 ,在酸性条件下发生以下镀镍反应:Ni2++
,在酸性条件下发生以下镀镍反应:Ni2++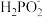 +=Ni+
+=Ni+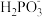 +。
+。①请完成并配平上述方程式
②上述反应中,若生成1 mol
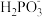 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为(2)①高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,若生成2 mol Na2FeO4,则反应中电子转移的物质的量为
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+1 mg的水体样本,需要1.2 mg·L-1高铁酸钾
(3)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL 5mol/L盐酸中,再加入一定量铁粉恰好溶解,收集到2.24 L(标准状况)气体,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
您最近一年使用:0次



