(1)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。化学镀镍的溶液中含有Ni2+和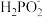 ,在酸性条件下发生以下镀镍反应:Ni2++
,在酸性条件下发生以下镀镍反应:Ni2++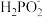 +=Ni+
+=Ni+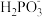 +。
+。
①请完成并配平上述方程式_____ 。
②上述反应中,若生成1 mol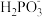 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为_____ 。
(2)①高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,若生成2 mol Na2FeO4,则反应中电子转移的物质的量为____ mol。
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+1 mg的水体样本,需要1.2 mg·L-1高铁酸钾____ L。
(3)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL 5mol/L盐酸中,再加入一定量铁粉恰好溶解,收集到2.24 L(标准状况)气体,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为____ 。
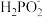 ,在酸性条件下发生以下镀镍反应:Ni2++
,在酸性条件下发生以下镀镍反应:Ni2++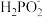 +=Ni+
+=Ni+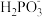 +。
+。①请完成并配平上述方程式
②上述反应中,若生成1 mol
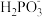 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为(2)①高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,若生成2 mol Na2FeO4,则反应中电子转移的物质的量为
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+1 mg的水体样本,需要1.2 mg·L-1高铁酸钾
(3)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL 5mol/L盐酸中,再加入一定量铁粉恰好溶解,收集到2.24 L(标准状况)气体,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
更新时间:2020-10-24 20:56:54
|
相似题推荐
【推荐1】汽车发生强烈碰撞时,安全气囊内的NaN3发生化学反应生成Na3N和N2所产生的N2快速充满气囊,可以达到保护车内人员的目的。
(1)写出上述反应的化学方程式:___________ ,它的基本反应类型属于___________ 。
(2)若安全气囊内含有97.5gNaN3,则其物质的量为___________ 。
(3)若97.5gNaN3完全分解,在标准状况下,气囊膨胀的体积约为___________ 。
(1)写出上述反应的化学方程式:
(2)若安全气囊内含有97.5gNaN3,则其物质的量为
(3)若97.5gNaN3完全分解,在标准状况下,气囊膨胀的体积约为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】氧化还原反应是一类重要的化学反应,在工农生产科学技术和日常生活中都有广泛的应用。
(1)①“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:___________ 。
② 毒性较强,常用NaHSO3处理工业废水中的
毒性较强,常用NaHSO3处理工业废水中的 ,请配平该反应
,请配平该反应___________ 。□H++□ +□
+□ =口Cr3++□
=口Cr3++□ +□H2O
+□H2O
(2)①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为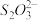 +4Cl2 +5H2O=2
+4Cl2 +5H2O=2 + 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为
+ 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为______ 。
②用HI和淀粉溶液可以检验加碘盐中是否存在KIO3,原理为KIO3+6HI=3I2+ KI +3H2O,氧化剂和还原剂的物质的量之比为_______________ 。
③钙元素是人体必须的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3 mol/L。现抽取某人血样10 mL,稀释后用草酸铵[ (NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0 mL5.0×10-3 mol/LKMnO4溶液与溶解得到的草酸恰好完全反应。则此人血液中Ca2+的浓度____ ,判断其 血液含钙量__________ (填“正常”或“不正常”)。(已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)
(1)①“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:
②
 毒性较强,常用NaHSO3处理工业废水中的
毒性较强,常用NaHSO3处理工业废水中的 ,请配平该反应
,请配平该反应 +□
+□ =口Cr3++□
=口Cr3++□ +□H2O
+□H2O(2)①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为
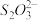 +4Cl2 +5H2O=2
+4Cl2 +5H2O=2 + 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为
+ 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为②用HI和淀粉溶液可以检验加碘盐中是否存在KIO3,原理为KIO3+6HI=3I2+ KI +3H2O,氧化剂和还原剂的物质的量之比为
③钙元素是人体必须的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3 mol/L。现抽取某人血样10 mL,稀释后用草酸铵[ (NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0 mL5.0×10-3 mol/LKMnO4溶液与溶解得到的草酸恰好完全反应。则此人血液中Ca2+的浓度
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】已知稀硝酸和铜能发生反应,生成硝酸铜、一氧化氮气体和水。
(1)请写出该反应的化学方程式,并用双线桥法标出反应中电子转移的方向和数目。________
(2)一次实验中,某同学用过量的稀硝酸(其密度为1.08 g·mL-1,HNO3的质量分数为12%)跟一定量的铜片反应,产生了标准状况下0.56 L的一氧化氮。试计算(简要写出计算过程):
①该稀硝酸的物质的量浓度(结果保留小数点后一位);______________
②被还原的HNO3的物质的量。________________
(1)请写出该反应的化学方程式,并用双线桥法标出反应中电子转移的方向和数目。
(2)一次实验中,某同学用过量的稀硝酸(其密度为1.08 g·mL-1,HNO3的质量分数为12%)跟一定量的铜片反应,产生了标准状况下0.56 L的一氧化氮。试计算(简要写出计算过程):
①该稀硝酸的物质的量浓度(结果保留小数点后一位);
②被还原的HNO3的物质的量。
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
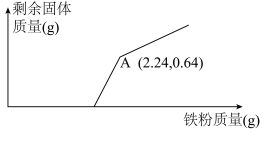
【推荐1】取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到1g白色沉淀.
①计算此钢样粉末中铁和碳的质量之比____________。
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:(标准状况下,2gH2的体积为22.4L)
请根据表中数据计算稀硫酸中H2SO4的质量分数_______。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
①计算此钢样粉末中铁和碳的质量之比____________。
②再取三份不同质量的钢样粉末分别加到50g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:(标准状况下,2gH2的体积为22.4L)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
请根据表中数据计算稀硫酸中H2SO4的质量分数_______。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】将Cu2O与Fe2O3的混合物共ag加入20.0mL4.00mol·L-1的过量稀硫酸中,充分反应后剩余固体的质量为bg。请计算:
(1)若向反应后的溶液中加入40.0mLNaOH溶液能刚好使溶液中的所有金属离子完全沉淀,则该氢氧化钠溶液的物质的量浓度为__________________ mol·L-1。
(2)若a=7b,则混合物中Cu2O与Fe2O3的物质的量之比为__________________ 。
(1)若向反应后的溶液中加入40.0mLNaOH溶液能刚好使溶液中的所有金属离子完全沉淀,则该氢氧化钠溶液的物质的量浓度为
(2)若a=7b,则混合物中Cu2O与Fe2O3的物质的量之比为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】饮用水质量是关系人类健康的重要问题。
(1)Cl2是最早用于饮用水消毒的物质,写出Cl2溶于水发生反应的离子方程式:___ 。
(2)ClO2是一种高效、低毒的消毒剂,逐渐取代Cl2成为生产自来水的消毒剂,工业上用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应中氧化剂与还原剂物质的量之比为____ 。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、ClO2氧化性更强,是无二次污染的绿色水处理剂。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。由以上信息可知,相同条件下,高铁酸钠溶解度比高铁酸钾溶解度__ (填“大”或“小”)。高铁酸钾溶于水放出氧气,能杀菌消毒,生成能吸附水中悬浮物的氢氧化铁胶体。用一个离子方程式表示高铁酸钾处理水的过程____ 。干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应的还原剂是___ ,每生成1molNa2FeO4转移__ mol电子。
(1)Cl2是最早用于饮用水消毒的物质,写出Cl2溶于水发生反应的离子方程式:
(2)ClO2是一种高效、低毒的消毒剂,逐渐取代Cl2成为生产自来水的消毒剂,工业上用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应中氧化剂与还原剂物质的量之比为
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、ClO2氧化性更强,是无二次污染的绿色水处理剂。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。由以上信息可知,相同条件下,高铁酸钠溶解度比高铁酸钾溶解度
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】将2.56g硫与足量NaOH的热溶液充分反应生成Na2S和Na2S2O3,然后向生成物中加入足量的NaClO和NaOH的混合溶液,硫元素全部转化为Na2SO4,第二步过程中转移电子nmol.求:n=____ mol;写出计算过程__________ 。
您最近一年使用:0次
【推荐2】已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
①NH4NO3 NH3↑+HNO3↑②NH4NO3
NH3↑+HNO3↑②NH4NO3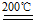 N2O↑+2H2O↑
N2O↑+2H2O↑
③2NH4NO3 2N2↑+O2↑+4X↑④4NH4NO3
2N2↑+O2↑+4X↑④4NH4NO3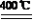 3N2↑+2NO2↑+8H2O↑
3N2↑+2NO2↑+8H2O↑
请回答下列问题:
(1)这四个反应中属于氧化还原反应的有___ 个。
(2)反应③中物质X的化学式是___ 。
(3)反应④中氧化产物和还原产物依次是___ 、___ 。(填化学式)
(4)若反应③生成标准状况下的11.2L氧气,则转移电子数为___ 。
①NH4NO3
 NH3↑+HNO3↑②NH4NO3
NH3↑+HNO3↑②NH4NO3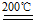 N2O↑+2H2O↑
N2O↑+2H2O↑③2NH4NO3
 2N2↑+O2↑+4X↑④4NH4NO3
2N2↑+O2↑+4X↑④4NH4NO3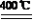 3N2↑+2NO2↑+8H2O↑
3N2↑+2NO2↑+8H2O↑请回答下列问题:
(1)这四个反应中属于氧化还原反应的有
(2)反应③中物质X的化学式是
(3)反应④中氧化产物和还原产物依次是
(4)若反应③生成标准状况下的11.2L氧气,则转移电子数为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】一种由CuO和KHC2O4溶液反应得到的蓝色结晶[KaCub(C2O4)c·dH2O]。为测定其组成,进行了如下实验:
步骤1:称取3.5400g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100mL溶液A。
步骤2:量取20.00mLA溶液,滴加0.2000mol·L-1KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00mL。
步骤3:另取20.00mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16g。
已知:步骤2中发生反应如下,请配平:___ 。
 + H2C2O4+ H+= Mn2++ CO2↑+ H2O
+ H2C2O4+ H+= Mn2++ CO2↑+ H2O
(1)3.5400g该样品中含n( )=
)=___ mol。
(2)3.5400g该样品中含n(Cu2+)=___ mol。
(3)通过计算确定该蓝色晶体的化学式(计算过程)___ 。
步骤1:称取3.5400g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100mL溶液A。
步骤2:量取20.00mLA溶液,滴加0.2000mol·L-1KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00mL。
步骤3:另取20.00mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16g。
已知:步骤2中发生反应如下,请配平:
 + H2C2O4+ H+= Mn2++ CO2↑+ H2O
+ H2C2O4+ H+= Mn2++ CO2↑+ H2O(1)3.5400g该样品中含n(
 )=
)=(2)3.5400g该样品中含n(Cu2+)=
(3)通过计算确定该蓝色晶体的化学式(计算过程)
您最近一年使用:0次