名校
解题方法
1 . 某化学课题小组将二氧化硫的制备与多个性质实验进行了一体化设计,实验装置如图所示。已知: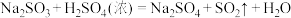 ,下列说法错误的是
,下列说法错误的是
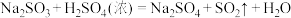 ,下列说法错误的是
,下列说法错误的是
A.a、b、c中盛装物质可以分别为浓硫酸、 固体、 固体、 溶液 溶液 |
B.实验时,湿润的pH试纸、鲜花、品红溶液、酸性 溶液均褪色, 溶液均褪色, 溶液中出现淡黄色沉淀 溶液中出现淡黄色沉淀 |
C.此设计可证明 水溶液呈酸性, 水溶液呈酸性, 具有氧化性、还原性、漂白性 具有氧化性、还原性、漂白性 |
D.点燃酒精灯加热,可证明 使品红溶液褪色具有可逆性,使酸性 使品红溶液褪色具有可逆性,使酸性 溶液褪色不具有可逆性 溶液褪色不具有可逆性 |
您最近一年使用:0次
2024-02-02更新
|
478次组卷
|
3卷引用:浙江金华第一中学2023-2024学年高一下学期4月期中考试化学试题
浙江金华第一中学2023-2024学年高一下学期4月期中考试化学试题河南省南阳市2023-2024学年高一上学期1月期末化学试题(已下线)专题01 硫及其化合物(考点清单)(讲+练)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)
解题方法
2 . Ⅰ.下面是某校化学研究性学习小组探究足量锌与浓硫酸反应的实验:甲同学设计如图实验验证该反应产生的混合气体中含有SO2、H2、H2O,已知装置C中试剂过量。
A. B.
B. C.
C. D.
D. E.
E.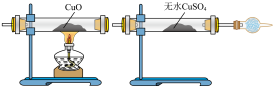 F.
F.
(1)按气体从左到右的流向,气体流经的各装置连接顺序是:________ 。
___________→___________→___________→___________→___________→___________
(2)证明混合气体中含有H2的实验现象为___________ 。
乙同学设计如下实验步骤测定44.8L(标准状况下)混合气体中SO2的体积分数。

(3)W溶液可以是___________(填序号)。
(4)该混合气体中二氧化硫的体积分数为___________ (用含m的代数式表示)。
Ⅱ.电子工业中,常用FeCl3溶液“腐蚀”覆铜板制作印刷电路板。某兴趣小组设计了印刷电路板腐蚀液再生和铜回收的新方法,具体步骤如下图所示

(5)写出生成印刷电路板“腐蚀废液”的离子方程式___________ 。
(6)下列说法错误的是___________ 。
A.滤渣③的成分是Cu
B.④可以是稀盐酸,不能用稀硫酸
C.通入⑥时发生反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-
A.
 B.
B. C.
C. D.
D. E.
E. F.
F.
(1)按气体从左到右的流向,气体流经的各装置连接顺序是:
___________→___________→___________→___________→___________→___________
(2)证明混合气体中含有H2的实验现象为
乙同学设计如下实验步骤测定44.8L(标准状况下)混合气体中SO2的体积分数。

(3)W溶液可以是___________(填序号)。
| A.H2O2溶液 | B.酸性KMnO4溶液 | C.溴水 | D.稀硫酸 |
(4)该混合气体中二氧化硫的体积分数为
Ⅱ.电子工业中,常用FeCl3溶液“腐蚀”覆铜板制作印刷电路板。某兴趣小组设计了印刷电路板腐蚀液再生和铜回收的新方法,具体步骤如下图所示

(5)写出生成印刷电路板“腐蚀废液”的离子方程式
(6)下列说法错误的是
A.滤渣③的成分是Cu
B.④可以是稀盐酸,不能用稀硫酸
C.通入⑥时发生反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-
您最近一年使用:0次
解题方法
3 . 向 固体和200mL 1
固体和200mL 1
 形成的混合后的溶液中通入过量
形成的混合后的溶液中通入过量 ,可观察到有大量白色沉淀,某学习小组为进一步探究该过程中氧化
,可观察到有大量白色沉淀,某学习小组为进一步探究该过程中氧化 的微粒,设计并完成以下步骤:
的微粒,设计并完成以下步骤:
(1)向 固体、100mL 0.02
固体、100mL 0.02 盐酸和100mL 6.0
盐酸和100mL 6.0
 形成的混合液中通过量
形成的混合液中通过量 ,观察到白色沉淀。
,观察到白色沉淀。
(2)向 固体和200mL 1.0
固体和200mL 1.0
 形成的混合液中通过量
形成的混合液中通过量 ,观察到白色沉淀。
,观察到白色沉淀。
(3)取少量步骤(2)反应后的上层清液,滴入0.1
 溶液,观察到蓝色沉淀。
溶液,观察到蓝色沉淀。
已知:1.0
 溶液的pH约为2,不同浓度
溶液的pH约为2,不同浓度 被还原时产物不同,不同pH时
被还原时产物不同,不同pH时 的氧化能力也不同。
的氧化能力也不同。
下列说法不正确的是
 固体和200mL 1
固体和200mL 1
 形成的混合后的溶液中通入过量
形成的混合后的溶液中通入过量 ,可观察到有大量白色沉淀,某学习小组为进一步探究该过程中氧化
,可观察到有大量白色沉淀,某学习小组为进一步探究该过程中氧化 的微粒,设计并完成以下步骤:
的微粒,设计并完成以下步骤:(1)向
 固体、100mL 0.02
固体、100mL 0.02 盐酸和100mL 6.0
盐酸和100mL 6.0
 形成的混合液中通过量
形成的混合液中通过量 ,观察到白色沉淀。
,观察到白色沉淀。(2)向
 固体和200mL 1.0
固体和200mL 1.0
 形成的混合液中通过量
形成的混合液中通过量 ,观察到白色沉淀。
,观察到白色沉淀。(3)取少量步骤(2)反应后的上层清液,滴入0.1

 溶液,观察到蓝色沉淀。
溶液,观察到蓝色沉淀。已知:1.0

 溶液的pH约为2,不同浓度
溶液的pH约为2,不同浓度 被还原时产物不同,不同pH时
被还原时产物不同,不同pH时 的氧化能力也不同。
的氧化能力也不同。下列说法不正确的是
A.步骤(1)说明酸性条件下 能氧化 能氧化 |
B.步骤(2)反应的离子方程式: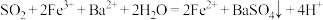 |
C.步骤(2)已证明 能氧化 能氧化 ,因此步骤(3)可舍去 ,因此步骤(3)可舍去 |
D.综合上述步骤,说明题干中 是 是 溶液的 溶液的 和酸性条件下 和酸性条件下 共同氧化的 共同氧化的 |
您最近一年使用:0次
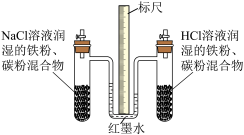
4 . 下列有关说法错误的是
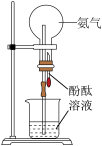 | 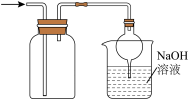 | 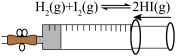 |  |
图① | 图② | 图③ | 图④ |
| A.图①实验能用于证明氨气极易溶于水 |
| B.图②实验可用于收集SO2并吸收多余的SO2 |
| C.由图③实验可知增大气体总压强化学平衡向左移动 |
| D.利用图④实验可探究生铁在不同条件下的电化学腐蚀 |
您最近一年使用:0次
2023-05-18更新
|
589次组卷
|
5卷引用:浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题
浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题(已下线)专题03 化学实验基础(3大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)湖南省部分学校2023届高三下学期5月联考化学试题广东省部分学校2023届高三5月联合考试化学试题四川省攀枝花市第十五中学校2023-2024学年高三上学期9月第一次统一考试理综化学试题
解题方法
5 . 已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
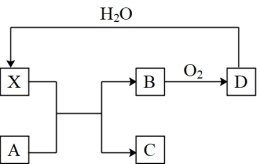

| A.X使蔗糖变黑的现象主要体现了X的强氧化性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,将气体B通入品红溶液褪色,证明B有还原性 |
| D.工业上,B转化为D的反应条件为加热、使用催化剂 |
您最近一年使用:0次
名校
解题方法
6 . 某同学用如图装置进行铜与浓硫酸反应的实验(加热和夹持装置已略去):

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A;
③将铜丝上提离开液面,停止加热。
(1)A中发生反应的化学方程式为____ 。
(2)若仪器B的作用是收集反应产生的SO2,请在虚线框中将该装置补充完整___ 。
(3)证明仪器B中SO2气体已经收集满的现象是___ 。
(4)下列有关该实验说法不正确 的是___ 。
A.浓硫酸与铜的反应中,浓硫酸只表现酸性
B.上下移动A中铜丝可控制生成SO2的量
C.实验后为避免仪器A中残留SO2泄漏,可将导管通入盛有NaOH溶液的烧杯中,打开旋塞E,缓缓从E向A中鼓入足量空气
D.如果铜丝足量,仪器A中的硫酸可反应完全

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A;
③将铜丝上提离开液面,停止加热。
(1)A中发生反应的化学方程式为
(2)若仪器B的作用是收集反应产生的SO2,请在虚线框中将该装置补充完整
(3)证明仪器B中SO2气体已经收集满的现象是
(4)下列有关该实验说法
A.浓硫酸与铜的反应中,浓硫酸只表现酸性
B.上下移动A中铜丝可控制生成SO2的量
C.实验后为避免仪器A中残留SO2泄漏,可将导管通入盛有NaOH溶液的烧杯中,打开旋塞E,缓缓从E向A中鼓入足量空气
D.如果铜丝足量,仪器A中的硫酸可反应完全
您最近一年使用:0次
2021-06-25更新
|
372次组卷
|
3卷引用:浙江省杭州市余杭、临平、萧山2020-2021学年高一下学期期末学业水平测试化学试题
名校
解题方法
7 . 为探究SO2与Fe3+间是否发生氧化还原反应,按如图装置进行实验(夹持、加热仪器略),下列说法不正确 的是


| A.A中的反应体现了浓硫酸的氧化性和酸性 |
| B.试剂a不能使用饱和NaHCO3溶液 |
| C.C中溶液c(H+)增大,可证明Fe3+氧化了SO2 |
| D.尾气可用NaOH溶液吸收 |
您最近一年使用:0次
2022-02-28更新
|
413次组卷
|
8卷引用:浙江省嘉兴八校联盟2021-2022学年高一下学期期中联考化学试题
浙江省嘉兴八校联盟2021-2022学年高一下学期期中联考化学试题北京师范大学附属中学2021-2022学年高三上学期期中考试化学试题(已下线)专题36 物质的制备及实验方案的设计与评价(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)河北省邯郸市大名县第一中学2021-2022学年高一上学期第二次月考化学试题广东省广州市育才中学2021-2022学年高一下学期期中考试化学试题广东省广州科学城中学2022-2023学年高一下学期期中考试化学试题江苏省苏州市吴中区苏苑高级中学2023-2024学年高一上学期12月月考化学试题
8 . 如图,在注射器中加入少量Na2SO3晶体。并吸入少量浓硫酸(以不接触纸条为准)。
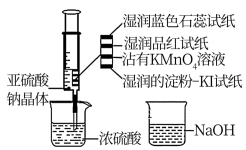
则下列有关说法错误的是

则下列有关说法错误的是
| A.蓝色石蕊试纸只变红 |
| B.NaOH溶液可用于除去实验中多余的SO2 |
| C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2 |
| D.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明SO2的漂白性 |
您最近一年使用:0次
名校
9 . 保险粉Na2S2O4大量用于印染业,并用来漂白纸张、纸浆和陶土等。某化学兴趣小组同学用甲酸法制取保险粉的装置如图所示(加持装置略去)。
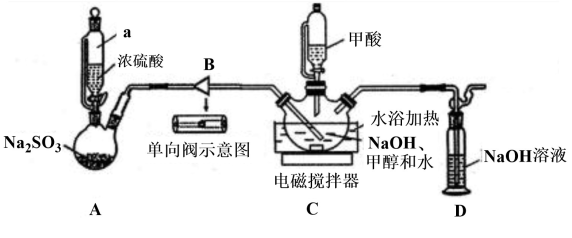
已知:保险粉易溶于水,不溶于甲醇,具有强还原性,在空气中易被氧化:2Na2S2O4+O2+2H2O=NaHSO3或Na2S2O4 +O2+H2O =NaHSO3+NaHSO4。实验时先把甲酸(HCOOH)与溶于甲醇和水混合溶剂的NaOH混合,再通入SO2气体。回答下列问题:
(1)仪器a的名称是______ ;装置B的作用是______ 。
(2)装置C中甲醇不参加反应,甲醇的作用是______ ;生成Na2S2O4的离子方程式为______ 。
(3)下列有关该实验的说法正确的是______ (填序号)。
A.可用硝酸和BaCl2溶液检验制得的Na2S2O4中是否混有NaHSO4
B.实验中甲酸和NaOH最合适的物质的量之比为1:1
C.用N2排尽装置内的空气,有利于提高 的Na2S2O4纯度
D.得到Na2S2O4固体后可用甲醇洗涤
(4)测定产品中Na2S2O4质量分数,其实验步骤如下,准确称取0.5000g产品放入锥形瓶中,加入适量水使其溶解。然后加入足量甲醛,充分反应,再滴加几滴指示剂,用0.2000mol·L-1的标准I2溶液滴定,至终点时,消耗25.00mL标准I2溶液。实验过程中涉及的反应:Na2S2O4+2HCHO+H2O =NaHSO3·HCHO+NaHSO2·HCHO;NaHSO2·HCHO+2I2+2H2O= NaHSO4+HCHO+4HI。该实验加入指示剂是______ ,产品Na2S2O4 (M=174g·mol-1)的质量分数为 ______ % (保留一位小数)。
(5)探究Na2S2O4的性质。隔绝空气加热Na2S2O4固体完全分解是到固体产物Na2SO3,Na2S2O3和SO2,但该兴趣小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______ 。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、KMnO4溶液)

已知:保险粉易溶于水,不溶于甲醇,具有强还原性,在空气中易被氧化:2Na2S2O4+O2+2H2O=NaHSO3或Na2S2O4 +O2+H2O =NaHSO3+NaHSO4。实验时先把甲酸(HCOOH)与溶于甲醇和水混合溶剂的NaOH混合,再通入SO2气体。回答下列问题:
(1)仪器a的名称是
(2)装置C中甲醇不参加反应,甲醇的作用是
(3)下列有关该实验的说法正确的是
A.可用硝酸和BaCl2溶液检验制得的Na2S2O4中是否混有NaHSO4
B.实验中甲酸和NaOH最合适的物质的量之比为1:1
C.用N2排尽装置内的空气,有利于提高 的Na2S2O4纯度
D.得到Na2S2O4固体后可用甲醇洗涤
(4)测定产品中Na2S2O4质量分数,其实验步骤如下,准确称取0.5000g产品放入锥形瓶中,加入适量水使其溶解。然后加入足量甲醛,充分反应,再滴加几滴指示剂,用0.2000mol·L-1的标准I2溶液滴定,至终点时,消耗25.00mL标准I2溶液。实验过程中涉及的反应:Na2S2O4+2HCHO+H2O =NaHSO3·HCHO+NaHSO2·HCHO;NaHSO2·HCHO+2I2+2H2O= NaHSO4+HCHO+4HI。该实验加入指示剂是
(5)探究Na2S2O4的性质。隔绝空气加热Na2S2O4固体完全分解是到固体产物Na2SO3,Na2S2O3和SO2,但该兴趣小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是
您最近一年使用:0次
2020-12-21更新
|
1181次组卷
|
6卷引用:解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)四川省成都市第七中学2021届高三一诊模拟考试理综化学试题(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练江西省南昌市第二中学2021-2022学年高三上学期第一次检测理综化学试题辽宁省沈阳市第一二〇中学2021-2022学年高三上学期第四次质量监测化学试题
名校
解题方法
10 . 为探究铁和硫反应产物中铁的化合价,某同学设计了如下所示的实验过程:

已知:①铁和硫反应产物不溶于碱,能溶于硫酸
②硫可溶于热碱溶液,发生类似于 Cl2和 NaOH 溶液的化学反应下列说法不正确的是

已知:①铁和硫反应产物不溶于碱,能溶于硫酸
②硫可溶于热碱溶液,发生类似于 Cl2和 NaOH 溶液的化学反应下列说法不正确的是
| A.混合粉末应在 N2 氛围中进行加热,所用 H2SO4溶液应先煮沸 |
| B.取溶液 A,滴加 KSCN 溶液,未出现红色,可证明铁和硫反应只有+2 价铁生成 |
| C.滤渣用稀 H2SO4 溶解时应在通风橱中进行 |
D.硫溶于热碱溶液可能发生的离子反应是3S+6OH- 2S2-+SO32-+3H2O 2S2-+SO32-+3H2O |
您最近一年使用:0次
2020-05-21更新
|
177次组卷
|
2卷引用:浙江省嘉兴市2020届高三年级教学质量评估化学试题



