名校
1 . 工业氯气通过电解饱和食盐水制得
(1)图(1)中,铁棒作_______ 极,电极反应式是_______ 。
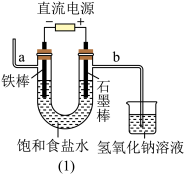
(2)检验导管b出来的气体可以用_______ ,反应的化学方程式是:_______ ;电解饱和食盐水的化学反应方程式为_______ 。
(3)图(1)方法制得的固体烧碱中可能混有少量NaCl,请写出检验是否混有NaCl的实验方法:_______ 。
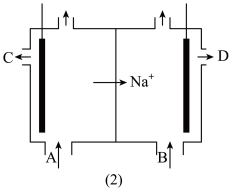
(4)下列关于图(2)的说法正确的是_______。
(5)工业上利用 与
与 反应制盐酸时使用过量的
反应制盐酸时使用过量的 ,理由是
,理由是_______ 。
A.氯气有毒 B.氯气可溶于水 C.氢气密度小
(1)图(1)中,铁棒作

(2)检验导管b出来的气体可以用
(3)图(1)方法制得的固体烧碱中可能混有少量NaCl,请写出检验是否混有NaCl的实验方法:
(4)下列关于图(2)的说法正确的是_______。

| A.A与C、B与D溶质相同 | B.A、B通入的均为浓溶液 |
| C.理论上NaCl利用率可达100% | D.图(2)是负离子交换膜法示意图 |
(5)工业上利用
 与
与 反应制盐酸时使用过量的
反应制盐酸时使用过量的 ,理由是
,理由是A.氯气有毒 B.氯气可溶于水 C.氢气密度小
您最近一年使用:0次
名校
解题方法
2 . 氯气是氯碱工业的主要产品之一,是一种常用的消毒刹,其消毒原理是与水反应生成了次氯酸,次氯酸的强氧化性能杀死水中的病菌。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯气与水反应的离子方程式为______________________________ 。
(2)将氯气通入淀粉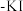 溶液中,溶液变蓝,写出反应的离子方程式
溶液中,溶液变蓝,写出反应的离子方程式____________________ ;继续通入氯气,蓝色消失,原因是: ,该反应体现了氯气的
,该反应体现了氯气的__________ 性。
(3)泳池用含氯物质消毒时,需要保证一定量的余氯,若水中的余氯以次氯酸形式存在,再加入 进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与
进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与 发生反应生成盐酸的化学方程式
发生反应生成盐酸的化学方程式____________________ 。
(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为_________________________ 。
(5)二氧化氯( )是国际上公认为安全、.无毒的绿色消毒剂。工业上制取
)是国际上公认为安全、.无毒的绿色消毒剂。工业上制取 的化学方程式如下:
的化学方程式如下: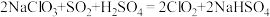 。按要求回答下列问题:
。按要求回答下列问题:
①该反应的离子方程式为____________________ 。
②另一种制备 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 与
与 的物质的量之比为
的物质的量之比为 ,则每生成
,则每生成 ,转移
,转移_________ 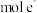 。
。
(1)氯气与水反应的离子方程式为
(2)将氯气通入淀粉
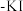 溶液中,溶液变蓝,写出反应的离子方程式
溶液中,溶液变蓝,写出反应的离子方程式 ,该反应体现了氯气的
,该反应体现了氯气的(3)泳池用含氯物质消毒时,需要保证一定量的余氯,若水中的余氯以次氯酸形式存在,再加入
 进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与
进行消毒反而会导致藻类生长,池水变绿。写出次氯酸与 发生反应生成盐酸的化学方程式
发生反应生成盐酸的化学方程式(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为
(5)二氧化氯(
 )是国际上公认为安全、.无毒的绿色消毒剂。工业上制取
)是国际上公认为安全、.无毒的绿色消毒剂。工业上制取 的化学方程式如下:
的化学方程式如下: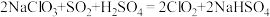 。按要求回答下列问题:
。按要求回答下列问题:①该反应的离子方程式为
②另一种制备
 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 与
与 的物质的量之比为
的物质的量之比为 ,则每生成
,则每生成 ,转移
,转移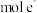 。
。
您最近一年使用:0次
23-24高一上·全国·课时练习
解题方法
3 . 通过H2在Cl2中的燃烧,你对燃烧的条件及其本质有什么新的认识?_____________
您最近一年使用:0次
23-24高一上·全国·课时练习
解题方法
4 . 条件不同对H2与Cl2反应有什么影响?_____________
您最近一年使用:0次
解题方法
5 . 整理氯及其化合物的有关知识,完成下列各题。
(1)列举你知道的氯及其化合物_______ 。
(2)从不同角度对你所列举的物质进行分类_______ 。
(3)如何实现这些物质之间的转化?写出其中主要反应的化学方程式_______ 。
(1)列举你知道的氯及其化合物
(2)从不同角度对你所列举的物质进行分类
(3)如何实现这些物质之间的转化?写出其中主要反应的化学方程式
您最近一年使用:0次
解题方法
6 . 写出下列反应的化学方程式,标出电子转移的方向和数目,并指出氯气在反应中表现出什么性质。
(1)氢气在氯气中燃烧_______ 。
(2)氯气与氢氧化钠反应_______ 。
(3)铁在氯气中燃烧_______ 。
(1)氢气在氯气中燃烧
(2)氯气与氢氧化钠反应
(3)铁在氯气中燃烧
您最近一年使用:0次
21-22高一上·全国·课前预习
7 . 氯气的化学性质
(1)氯气是很活泼的非金属单质,具有强___________ 性。
(2)与金属单质的反应
2Na+Cl2 2NaCl,产生
2NaCl,产生___________ 。
2Fe+3Cl2
___________ ,产生___________ ,加水溶解所得溶液呈___________ 色(Fe3+的颜色)。
Cu+Cl2 CuCl2,产生
CuCl2,产生___________ ,加水溶解所得溶液呈___________ 。
(3)与非金属单质的反应
[实验探究]H2在Cl2中燃烧
(4)与水的反应
①Cl2溶于水,Cl2的水溶液称为。在常温下,溶于水的氯气部分与水反应生成了盐酸和次氯酸,反应的化学方程式为___________ ,离子方程式为___________ 。
从化合价的角度看,该反应中氯元素的化合价既有升高又有降低,故Cl2既是氧化剂又是还原剂。
②氯水的性质
[注意]干燥的氯气不具有漂白性,潮湿的氯气才具有漂白性,实际上起作用的是Cl2与水反应生成的HClO。
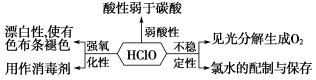
③次氯酸的性质
(5)与碱的反应
①化学方程式:Cl2+2NaOH=_________+H2O,_________ ,离子方程式:_________
漂白液的有效成分是_________ 。
②制取漂白粉
2Cl2+2Ca(OH)2=_________+2H2O_________
漂白粉的有效成分是_________ ,其主要成分是CaCl2和Ca(ClO)2。
Cl2与Ca(OH)2反应充分,并使_________ 成为主要成分,则得到漂粉精。
[注意]氯气所发生的反应均为氧化还原反应,反应中氯气通常为氧化剂,但Cl2与碱反应时,Cl2既是氧化剂又是还原剂。
(1)氯气是很活泼的非金属单质,具有强
(2)与金属单质的反应
2Na+Cl2
 2NaCl,产生
2NaCl,产生2Fe+3Cl2

Cu+Cl2
 CuCl2,产生
CuCl2,产生(3)与非金属单质的反应
[实验探究]H2在Cl2中燃烧
| 实验操作 | 实验现象 | 实验结论 |
| 在空气中点燃H2后,把导管缓慢伸入盛满氯气的集气瓶中 | 氢气在氯气中安静地燃烧,发出 | H2+Cl2 2HCl,反应生成的HCl极易溶于水,溶于水得到的溶液即为 2HCl,反应生成的HCl极易溶于水,溶于水得到的溶液即为 |
①Cl2溶于水,Cl2的水溶液称为。在常温下,溶于水的氯气部分与水反应生成了盐酸和次氯酸,反应的化学方程式为
从化合价的角度看,该反应中氯元素的化合价既有升高又有降低,故Cl2既是氧化剂又是还原剂。
②氯水的性质
| 实验操作 | 实验现象 | 结论 |
 | 有色布条 | 干燥的Cl2 |
 | 有色布条 | 氯水有漂白作用,起漂白作用的是HClO |
③次氯酸的性质

(5)与碱的反应
①化学方程式:Cl2+2NaOH=_________+H2O,
漂白液的有效成分是
②制取漂白粉
2Cl2+2Ca(OH)2=_________+2H2O
漂白粉的有效成分是
Cl2与Ca(OH)2反应充分,并使
[注意]氯气所发生的反应均为氧化还原反应,反应中氯气通常为氧化剂,但Cl2与碱反应时,Cl2既是氧化剂又是还原剂。
您最近一年使用:0次



