名校
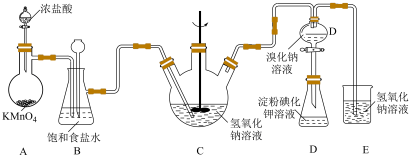
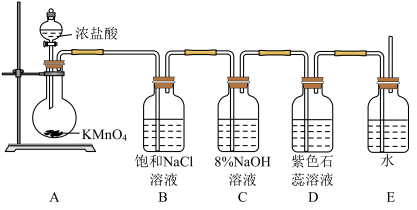
1 . 寒冬袭来,病毒肆虐,含氯消毒剂在控制病原微生物污染和传播等方面有着重要作用。某校课外化学小组设计如图所示装置制备少量氯气并进行系列实验(夹持仪器已略)。
已知淀粉溶液遇碘单质变蓝;卤素单质在水中的颜色如表所示:
(1)请写出实验室用 与浓盐酸制氯气的化学方程式
与浓盐酸制氯气的化学方程式___________ ;
(2)装置B的作用是___________ ;
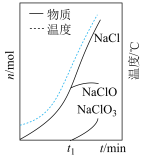
(3)装置C中生成各物质的物质的量和溶液的温度随时间的变化如下图所示。写出 分钟后氧化产物只有
分钟后氧化产物只有 的反应,对应的化学方程式
的反应,对应的化学方程式___________ ;
(4)设计装置D、E的目的是验证氧化性 。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为
。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为___________ 色,若打开装置D的活塞,使D中溶液滴入装置E,可以观察到的现象是___________ ,经认真考虑,有同学提出该实验方案仍有不足,你若同意该建议,请说明其中不足的原因是___________ ;(若不同意,则该空不用写)
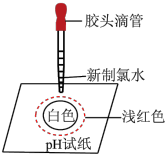
(5)某同学在pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是___________。

已知淀粉溶液遇碘单质变蓝;卤素单质在水中的颜色如表所示:
| 卤素单质 |  |  |  |
| 水溶液颜色 | 黄绿色 | 橙黄色 | 棕黄色 |
(1)请写出实验室用
 与浓盐酸制氯气的化学方程式
与浓盐酸制氯气的化学方程式(2)装置B的作用是
(3)装置C中生成各物质的物质的量和溶液的温度随时间的变化如下图所示。写出
 分钟后氧化产物只有
分钟后氧化产物只有 的反应,对应的化学方程式
的反应,对应的化学方程式
(4)设计装置D、E的目的是验证氧化性
 。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为
。当向D中缓缓通入一定量氯气时,可以看到D中无色溶液逐渐变为(5)某同学在pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是___________。

A.该实验说明 分子具有漂白性 分子具有漂白性 |
B.该实验说明 扩散速率比HClO分子快 扩散速率比HClO分子快 |
| C.将实验后变白的pH试纸再滴入盐酸又会变红 |
| D.若用久置的氯水进行实验,现象相同 |
您最近一年使用:0次
2024-01-25更新
|
85次组卷
|
2卷引用:四川省绵阳市绵阳中学2023-2024学年高一上学期期末模拟测试化学试题
解题方法
2 . 某研究小组利用下图装置制备“84”消毒液并探究 的化学性质。已知:
的化学性质。已知: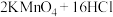 (浓)
(浓)
回答下列问题:
(1)盛装 的仪器名称是
的仪器名称是_______ ,本实验制备 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为_______ 。
(2)若将B与C装置的位置对调,对“84”消毒液有效成分产量的影响是______ (填“提高”“降低”或“无影响”),向制得的“84”消毒液中加入较多硫酸时会产生氯气,发生反应的离子方程式为______ 。
(3)D中可观察到的现象是_______ ,说明溶液中存在的微粒有_______ 。
(4)从环保角度考虑,对本实验装置的改进措施是_______ 。
(5)已知,还原性: 。按如下方案对其进行了证明,完成表格有关内容。
。按如下方案对其进行了证明,完成表格有关内容。
 的化学性质。已知:
的化学性质。已知: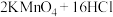 (浓)
(浓)

回答下列问题:
(1)盛装
 的仪器名称是
的仪器名称是 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(2)若将B与C装置的位置对调,对“84”消毒液有效成分产量的影响是
(3)D中可观察到的现象是
(4)从环保角度考虑,对本实验装置的改进措施是
(5)已知,还原性:
 。按如下方案对其进行了证明,完成表格有关内容。
。按如下方案对其进行了证明,完成表格有关内容。
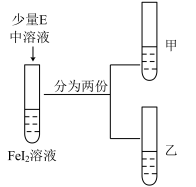
| 实验步骤 | 现象 |
| ①向甲试管中滴加淀粉溶液 | |
| ②向乙试管中滴加 |
您最近一年使用:0次
2023-02-18更新
|
178次组卷
|
2卷引用:四川省绵阳市2022-2023学年高一上学期期末考试化学试题
3 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。某化学实验小组模拟工业生产路线,在实验室中制备高铁酸钾,其实验装置如图:
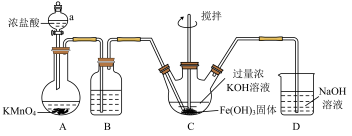
已知:K2FeO4易溶于水,水溶液为紫色,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。
(1)仪器a的名称是_________ 。
(2)装置A中发生反应的离子方程式为_________ 。
(3)装置B中试剂为________ 。
(4)装置C中观察到溶液的颜色变化为________ ,制备K2FeO4的化学方程式为______ ,加入过量浓KOH溶液的原因是_______ 。
(5)有同学提出,装置C在制备K2FeO4时存在一定缺陷,改进的措施是_______ 。
(6)装置D的作用是________ 。
(7)取C中洗涤并干燥后样品10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为________ 。

已知:K2FeO4易溶于水,水溶液为紫色,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。
(1)仪器a的名称是
(2)装置A中发生反应的离子方程式为
(3)装置B中试剂为
(4)装置C中观察到溶液的颜色变化为
(5)有同学提出,装置C在制备K2FeO4时存在一定缺陷,改进的措施是
(6)装置D的作用是
(7)取C中洗涤并干燥后样品10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为
您最近一年使用:0次
名校
解题方法
4 . 实验室利用下图装置制备KClO,并探究其性质。
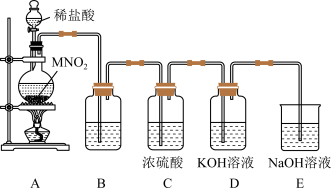
(1)盛放浓盐酸的仪器名称是_____ ,A中发生反应的离子方程式为______ 。
(2)B中盛放的试剂是______ ,其作用是_______ 。
(3)制备KClO的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是_____ 。
(4)E的作用是_______ ,下列不能代替E中NaOH溶液的是______ (填正确答案标号)。
A. 溶液 B.NaCl溶液 C.
溶液 B.NaCl溶液 C. 溶液 D.KI溶液
溶液 D.KI溶液
(5)在一支试管中依次加入氢氧化铁和氢氧化钾溶液,再加入KClO溶液,有紫红色的高铁酸钾( )生成,由此可知KClO具有
)生成,由此可知KClO具有_______ 性(填“氧化”或“还原”)。
(6)某化工厂的贮氯罐意外发生泄漏,消防员也向贮氯罐周围空气中喷洒稀NaOH溶液,发生反应的离子方程式:______ 。为了厂区和周围群众安全,组织群众疏散的地方应是_______ (填序号)。
A.顺风高坡处 B.逆风高坡处 C.顺风低洼处 D.逆风低洼处

(1)盛放浓盐酸的仪器名称是
(2)B中盛放的试剂是
(3)制备KClO的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是
(4)E的作用是
A.
 溶液 B.NaCl溶液 C.
溶液 B.NaCl溶液 C. 溶液 D.KI溶液
溶液 D.KI溶液(5)在一支试管中依次加入氢氧化铁和氢氧化钾溶液,再加入KClO溶液,有紫红色的高铁酸钾(
 )生成,由此可知KClO具有
)生成,由此可知KClO具有(6)某化工厂的贮氯罐意外发生泄漏,消防员也向贮氯罐周围空气中喷洒稀NaOH溶液,发生反应的离子方程式:
A.顺风高坡处 B.逆风高坡处 C.顺风低洼处 D.逆风低洼处
您最近一年使用:0次
2022-03-05更新
|
83次组卷
|
2卷引用:四川省绵阳南山中学双语学校2021-2022学年高一下学期入学考试化学试题
5 . Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取,反应装置如图所示(夹持装置已略)。
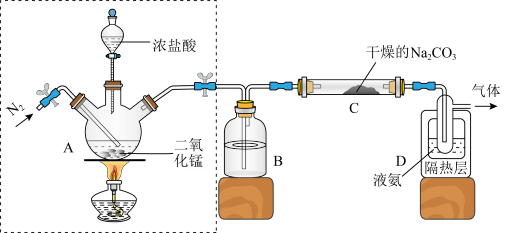
已知:Cl2O熔点为116℃,沸点为3.8℃,浓度过高或加热时易发生分解并爆炸。Cl2沸点为-34.6℃,液氨沸点为-33.5℃。
(1)写出装置A中发生反应的离子方程式:_______ 。
(2)检查虚框中装置气密性的方法为:用止水夹夹住装置A两端的橡胶管,_______ ,加水,一段时间后,水不能顺利流下,则气密性良好。
(3)下列有关该实验的说法中不正确的是_______ 。
A.实验室也可用KMnO4与浓盐酸反应制备氯气
B.B中试剂是浓硫酸,目的是干燥氯气
C.氮气的作用之一是稀释生成的Cl2O,减少实验爆炸危险
D.从装置D中逸出气体的主要成分是Cl2O
(4)①装置C中潮湿的Cl2与Na2CO3以等物质的量反应,生成NaHCO3、气体Cl2O和另一种盐X,试写出该反应化学方程式_______ 。
②设计实验方案验证C中生成的产物中另一种盐X中的阴离子_______ 。
(5)该实验装置存在一处明显的不足,其改进措施为_______ 。

已知:Cl2O熔点为116℃,沸点为3.8℃,浓度过高或加热时易发生分解并爆炸。Cl2沸点为-34.6℃,液氨沸点为-33.5℃。
(1)写出装置A中发生反应的离子方程式:
(2)检查虚框中装置气密性的方法为:用止水夹夹住装置A两端的橡胶管,
(3)下列有关该实验的说法中不正确的是
A.实验室也可用KMnO4与浓盐酸反应制备氯气
B.B中试剂是浓硫酸,目的是干燥氯气
C.氮气的作用之一是稀释生成的Cl2O,减少实验爆炸危险
D.从装置D中逸出气体的主要成分是Cl2O
(4)①装置C中潮湿的Cl2与Na2CO3以等物质的量反应,生成NaHCO3、气体Cl2O和另一种盐X,试写出该反应化学方程式
②设计实验方案验证C中生成的产物中另一种盐X中的阴离子
(5)该实验装置存在一处明显的不足,其改进措施为
您最近一年使用:0次
2021-05-21更新
|
363次组卷
|
4卷引用:四川省绵阳市南山中学2022-2023学年高一上学期12月线上测试化学试题
四川省绵阳市南山中学2022-2023学年高一上学期12月线上测试化学试题(已下线)【浙江新东方】高中化学20210513-018【2021】【高一下】(已下线)专题04 常见气体的实验室制取(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)新疆和田地区皮山县2022-2023学年高三上学期11月期中考试化学试题
6 . Ⅰ.实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如图:

(1)写出AlCl3与过量氨水反应的化学反应方程式__________ 。
(2)判断流程中沉淀是否洗净的操作是_______ ,高温焙烧时,用于盛放固体的仪器名称是________ 。
Ⅱ.无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用如图装置制备。
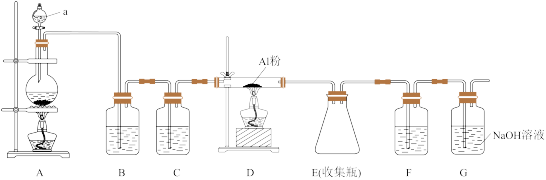
(3)仪器a的名称为:_________ 其中装置A用来制备氯气,写出装置A中烧瓶内发生反应的化学反应方程式:__________ 。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是_________ 。
(5)F中试剂是______ 。G为尾气处理装置,其中反应的离子反应方程式:________ 。
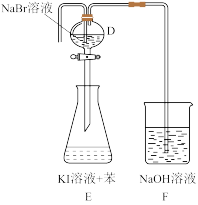
(6)若将C与如图的装置连接,设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色,发生反应的化学方程式为:_________ ,说明Cl2氧化性________ Br2(填>、<或=)。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_________ 。

(1)写出AlCl3与过量氨水反应的化学反应方程式
(2)判断流程中沉淀是否洗净的操作是
Ⅱ.无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用如图装置制备。

(3)仪器a的名称为:
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是
(5)F中试剂是
(6)若将C与如图的装置连接,设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色,发生反应的化学方程式为:

您最近一年使用:0次



