解题方法
1 .  为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”),简述判断依据。
为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”),简述判断依据。
(1)标准状况下,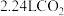 与足量的
与足量的 充分反应,转移的电子总数为
充分反应,转移的电子总数为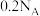 ,判断依据:
,判断依据:_______ 。
(2)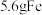 和
和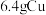 分别与
分别与 充分反应,转移的电子数均为
充分反应,转移的电子数均为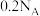 ,判断依据:
,判断依据:_______ 。
(3)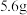 铁粉与硝酸反应失去的电子数一定为
铁粉与硝酸反应失去的电子数一定为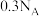 ,判断依据:
,判断依据:_______ 。
(4)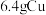 与S完全反应,转移的电子数为
与S完全反应,转移的电子数为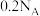 ,判断依据:
,判断依据:_______ 。
(5)向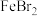 溶液中通入适量
溶液中通入适量 ,当有
,当有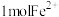 被氧化时,转移的电子总数一定等于
被氧化时,转移的电子总数一定等于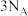 ,判断依据:
,判断依据:_______ 。
 为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”),简述判断依据。
为阿伏加德罗常数的值。请判断下列说法的正误(正确的打“√”,错误的打“×”),简述判断依据。(1)标准状况下,
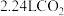 与足量的
与足量的 充分反应,转移的电子总数为
充分反应,转移的电子总数为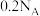 ,判断依据:
,判断依据:(2)
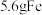 和
和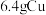 分别与
分别与 充分反应,转移的电子数均为
充分反应,转移的电子数均为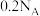 ,判断依据:
,判断依据:(3)
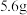 铁粉与硝酸反应失去的电子数一定为
铁粉与硝酸反应失去的电子数一定为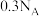 ,判断依据:
,判断依据:(4)
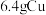 与S完全反应,转移的电子数为
与S完全反应,转移的电子数为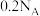 ,判断依据:
,判断依据:(5)向
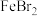 溶液中通入适量
溶液中通入适量 ,当有
,当有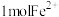 被氧化时,转移的电子总数一定等于
被氧化时,转移的电子总数一定等于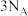 ,判断依据:
,判断依据:
您最近半年使用:0次
名校
解题方法
2 . 物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据如图所示,回答下列问题:

(1)Y是形成酸雨的主要物质之一,它溶于水反应的化学方程式为_____ ;另一类硝酸型酸雨主要由人类活动产生的NOx造成的,写出NO2与水反应的化学方程式为______ ;酸雨的pH______ (填范围)。
(2)Y能使品红溶液褪色,它与一种黄绿色气体等体积通入水中得到的溶液却几乎没有漂白性,反应的离子方程式为_______ ;Y也能使酸性高锰酸钾溶液褪色,写出该反应的离子方程式,并用单线桥法标明电子转移的方向和数目_____ ,体现了Y的_____ 性。
(3)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为_____ 。
(4)现用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL,回答下列问题:
①所需浓硫酸的体积为______ mL。
②将浓硫酸沿烧杯内壁缓缓注入盛水的烧杯中,不断搅拌的目的是_____ ,若搅拌过程中有液体溅出,会导致最终所配溶液浓度_____ (填“偏大”、“偏小”或“无影响”,下同)。
③在转入容量瓶前,烧杯中的液体应先_____ ,否则会使浓度_____ 。
(5)已知S的氧化性较弱,则硫粉与铜加热反应的化学方程式为_____ 。
(6)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_____ (填序号)。
A.Na2S+S B.Na2SO3+S C.Na2SO3+Na2SO4 D.SO2+Na2SO4

(1)Y是形成酸雨的主要物质之一,它溶于水反应的化学方程式为
(2)Y能使品红溶液褪色,它与一种黄绿色气体等体积通入水中得到的溶液却几乎没有漂白性,反应的离子方程式为
(3)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为
(4)现用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL,回答下列问题:
①所需浓硫酸的体积为
②将浓硫酸沿烧杯内壁缓缓注入盛水的烧杯中,不断搅拌的目的是
③在转入容量瓶前,烧杯中的液体应先
(5)已知S的氧化性较弱,则硫粉与铜加热反应的化学方程式为
(6)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是
A.Na2S+S B.Na2SO3+S C.Na2SO3+Na2SO4 D.SO2+Na2SO4
您最近半年使用:0次
2020-03-23更新
|
276次组卷
|
2卷引用:北京市海淀区中关村中学2021-2022学年高三上学期10月月考化学试题
18-19高一下·上海长宁·期中
3 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化,完成下列填空:
(1)写出硫与铁反应的化学方程式_____________________ ,所得产物的颜色为_________ 。
(2)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象是___________ ,硫化氢呈现______ (选填“氧化性”、“还原性”)。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是_________ 。
(4)硫酸盐的种类很多,且应用广泛,医疗上采用____ 作X射线透视肠胃的内服药剂。
(1)写出硫与铁反应的化学方程式
(2)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象是
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是
(4)硫酸盐的种类很多,且应用广泛,医疗上采用
您最近半年使用:0次



