名校
解题方法
1 . 实验小组设计图所示装置,验证SO2性质,对实验现象分析不正确的是

| A.通入SO2一段时间后,试管内时的CCl4溶液逐渐褪色,说明SO2具有还原性 |
| B.一段时间后试管内有白色沉淀,说明SO2与BaCl2反应生成BaSO3沉淀 |
| C.试管中的红色花瓣颜色变浅,说明SO2溶于水具有漂白性 |
| D.滴有酚酞的NaOH溶液红色变浅,说明SO2能与碱溶液反应 |
您最近一年使用:0次
2021-05-22更新
|
2279次组卷
|
11卷引用:北京市石景山区2021届高三一模化学试题
北京市石景山区2021届高三一模化学试题(已下线)第13讲 硫及其化合物(精练)-2022年高考化学一轮复习讲练测(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)2021年北京高考化学试题变式题1-10广东省潮州市潮安区宝山中学2021-2022学年高一下学期期中考试化学试题(已下线)第13讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)湖北省武汉海淀外国语实验学校2022-2023学年高三上学期10月月考化学试题(已下线)【浙江新东方】高中化学20210513-041【2021】【高一下】(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)江苏省苏州实验中学2021-2022学年第高一上学期12月月考调研化学试题安徽省当涂第一中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
2 . 某实验小组利用下图装置模拟古法硫酸生产方法并进行SO2性质探究。

已知A中反应的化学方程式:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
完成下列填空:
(1)C装置中覆盖食用油的目的是___________ ;D装置的作用___________ 。B中所得硫酸溶液的质量分数理论值为___________ (保留三位小数)。
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
得到如下pH-t图:
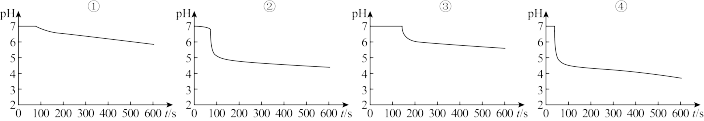
(2)曲线①呈缓慢下降趋势,这是因为___________ 。曲线②出现骤降,表明溶液中生成了___________ (填物质名称)。对比分析上述四组数据,可得出的结论是_________ (任写2条)。
(3)为对排气法收集到的SO2气体进行含量测定,将2240mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀21.436g。则SO2气体的体积分数为_______ 。若该实验数据较实际值偏大,则可能的原因是________ (选填编号)。
a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面

已知A中反应的化学方程式:2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。完成下列填空:
(1)C装置中覆盖食用油的目的是
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
| ① | ② | ③ | ④ |
| 已煮沸的BaCl2溶液 | 未煮沸的BaCl2溶液 | 已煮沸的Ba(NO3)2溶液 | 未煮沸的Ba(NO3)2溶液 |
| 注:锥形瓶中溶液体积相同,钡盐溶液浓度相同;油层厚度一致,通入SO2流速一致。 | |||

(2)曲线①呈缓慢下降趋势,这是因为
(3)为对排气法收集到的SO2气体进行含量测定,将2240mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀21.436g。则SO2气体的体积分数为
a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面
您最近一年使用:0次
2022-01-15更新
|
1079次组卷
|
3卷引用:上海市浦东新区2022届高三一模化学试题
上海市浦东新区2022届高三一模化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题
名校
解题方法
3 . 探究 与
与 溶液反应的实验装置如图所示。回答下列问题。
溶液反应的实验装置如图所示。回答下列问题。
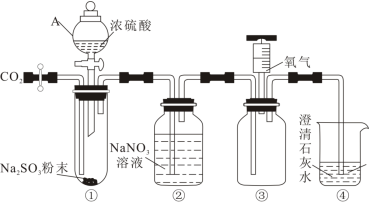
(1)仪器A在使用前应_______ 。装置连接完成后,先检查装置气密性,再加入试剂,通入 ,通入
,通入 的目的是
的目的是_______ ,直至装置④中现象为_______ ,停止通入 。
。
(2)将装置④中盛放 溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使
溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使 缓慢通入装置②中,直至装置②中反应完全,停止通入
缓慢通入装置②中,直至装置②中反应完全,停止通入 。将装置③注射器中氧气注入广口瓶,观察到
。将装置③注射器中氧气注入广口瓶,观察到_______ ,说明装置②中反应生成了NO,写出装置②中反应的离子方程式_______ 。
(3)为测定某亚硫酸钠样品的纯度,对上述装置进行如下改进。
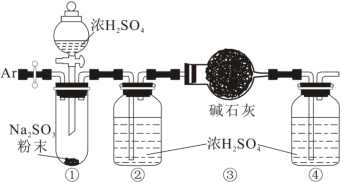
称取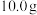 固体,进行如下实验:
固体,进行如下实验:
a.通入氩气排净装置①、②中的空气;
b.将盛有碱石灰的干燥管(总质量 )和装置④连接好;
)和装置④连接好;
c.打开分液漏斗活塞,向装置①中滴加浓硫酸;
d.续通入氩气,直至装置④收集到的Ar纯净;
e.拆除装置,称量装置③的总质量为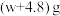 。
。
该样品中亚硫酸钠的纯度为_______ ;若实验中缺少步骤d,会使测定结果_______ (填“偏高”、“偏低”或“无影响”)。
 与
与 溶液反应的实验装置如图所示。回答下列问题。
溶液反应的实验装置如图所示。回答下列问题。
(1)仪器A在使用前应
 ,通入
,通入 的目的是
的目的是 。
。(2)将装置④中盛放
 溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使
溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使 缓慢通入装置②中,直至装置②中反应完全,停止通入
缓慢通入装置②中,直至装置②中反应完全,停止通入 。将装置③注射器中氧气注入广口瓶,观察到
。将装置③注射器中氧气注入广口瓶,观察到(3)为测定某亚硫酸钠样品的纯度,对上述装置进行如下改进。

称取
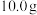 固体,进行如下实验:
固体,进行如下实验:a.通入氩气排净装置①、②中的空气;
b.将盛有碱石灰的干燥管(总质量
 )和装置④连接好;
)和装置④连接好;c.打开分液漏斗活塞,向装置①中滴加浓硫酸;
d.续通入氩气,直至装置④收集到的Ar纯净;
e.拆除装置,称量装置③的总质量为
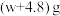 。
。该样品中亚硫酸钠的纯度为
您最近一年使用:0次
2022-01-10更新
|
541次组卷
|
3卷引用:河南省义马市高级中学2021-2022学年高三上学期11月份联考化学试题
河南省义马市高级中学2021-2022学年高三上学期11月份联考化学试题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)湖南省株洲市攸县第四中学2022-2023学年高三上学期第四次月考化学试题
名校
4 . 下列实验操作对应的现象不符合事实的是
 |  |  |  |
| A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡 | B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀 | C.将少量钠投入到无水乙醇中,钠表面有气泡产生 | D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来 |
| A.A | B.B | C.C... | D.D |
您最近一年使用:0次
2019-06-23更新
|
1445次组卷
|
6卷引用:新人教版必修2同步测试:5.1.1硫和二氧化硫
名校
解题方法
5 . 为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________ 。
(2)该实验可以证明SO2具有_________ 性;H2O2的氧化性_________ Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________ ,B中重新变成红棕色的原因____________________________________ (均用离子方程式表示)。
(4)C中产生的白色沉淀是______ 。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________ 的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
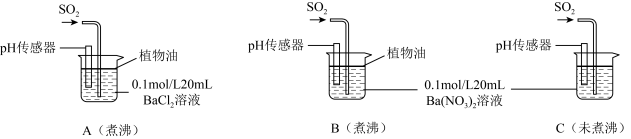
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________ 。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________ 。若实验B、C中通入足量的SO2后,溶液酸性:B_________ C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________ 。

| 实验操作 | 实验现象 |
| i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)该实验可以证明SO2具有
(3)B中红棕色褪去的原因
(4)C中产生的白色沉淀是
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:

①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是
您最近一年使用:0次
2020-01-18更新
|
647次组卷
|
3卷引用:专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教2019版必修第一册
6 . (NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4=N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O, 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
| A.生成的沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:1 |
| B.生成的沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:2 |
| C.生成的沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:3 |
| D.从溶液中逸出的气体只有N2,最后留下溶液中溶质只有较多的NH4Cl |
您最近一年使用:0次
2016-12-09更新
|
1515次组卷
|
10卷引用:2016届河南省豫南九校联盟高三下学期第一次联考化学试卷
2016届河南省豫南九校联盟高三下学期第一次联考化学试卷江西省南昌市新建县第一中学2020届高三上学期第一次月考化学试题上海市青浦区2015届高三上学期期末学业质量调研测试(一模)化学试题湖北省武汉市第十一中学2019-2020学年高一下学期期中测试化学试题黑龙江省哈尔滨市第九中学2021届高三上学期开学考试化学试题(已下线)小题必刷19 硫及其化合物——2021年高考化学一轮复习小题必刷(通用版)湖南省长沙市雅礼中学2021届高三第三次月考化学试题黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题福建省晋江市季延中学2018届高三上学期第二阶段检测化学试题第28届(2014年)浙江省高中学生化学竞赛预赛试题
11-12高二上·江苏扬州·期末
名校
7 . 下列五种有色溶液与SO2作用均能褪色,其实质相同的是( )
①品红溶液;②酸性KMnO4溶液;③溴水;④滴有酚酞的NaOH溶液;⑤含I2的淀粉溶液
①品红溶液;②酸性KMnO4溶液;③溴水;④滴有酚酞的NaOH溶液;⑤含I2的淀粉溶液
| A.①④ | B.①②③ | C.②③⑤ | D.③④ |
您最近一年使用:0次
2017-10-30更新
|
809次组卷
|
11卷引用:2010-2011学年江苏省扬州中学高二上学期期末考试化学试题(必修)
(已下线)2010-2011学年江苏省扬州中学高二上学期期末考试化学试题(必修)【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期期中考试化学试题重庆市第八中学2020-2021学年高一下学期期中考试化学试题重庆市渝高中学校2021-2022学年高一下学期期中考试化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高三上学期第三次月考化学试题重庆市渝高中学2022-2023学年高一下学期期中考试化学试题(已下线)第3讲 硫及其重要化合物2015届福建省泉州一中高三上学期期中考试化学试卷湖北省宜昌市葛洲坝中学2018届高三9月月考化学试题【全国百强校】黑龙江省双鸭山市第一中学2019届高三上学期第一次月考化学试题吉林省洮南市第一中学2021届高三上学期期中考试化学试题
10-11高三上·甘肃天水·阶段练习
名校
8 . 下列说法正确的是
| A.SO2能使FeCl3,KMnO4水溶液褪色 |
| B.可以用澄清石灰水鉴别SO2和CO2 |
| C.硫粉在过量的纯氧中燃烧可以生成SO3 |
| D.少量SO2通过浓的CaCl2溶液能生成白色沉淀 |
您最近一年使用:0次
2017-11-27更新
|
1068次组卷
|
9卷引用:同步君 必修1 第4章 第3节 二氧化硫和三氧化硫
(已下线)同步君 必修1 第4章 第3节 二氧化硫和三氧化硫高中化学人教版 必修1 第四章 非金属及其化合物 3.硫和氮的氧化物 二氧化硫和三氧化硫2018-2019学年苏教版高中化学必修一 专题综合测评4山东省莒县第一中学2018-2019学年高一上学期12月月考化学试题成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题(已下线)2011届甘肃省天水一中高三上学期第三次月考化学试卷2016-2017学年江西省上高县第二中学高一4月(第六次)月考化学试卷新疆哈密市第十五中学2019-2020学年高一下学期4月质量检测化学试题江苏省徐州市邳州市运河中学2020-2021学年高一上学期第二次学期调研化学试题
12-13高一上·吉林长春·期末
名校
9 . 下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是( )如下图所示),一定没有沉淀生成的是( )

| X | Y | Z | |
| A | NO2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | CaCl2 |
| D | CO2 | SO2 | CaCl2 |

| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-11-13更新
|
934次组卷
|
14卷引用:2011-2012学年吉林省长春外国语学校高一上学期期末考试理科化学试卷
(已下线)2011-2012学年吉林省长春外国语学校高一上学期期末考试理科化学试卷(已下线)2014年高考化学一轮复习课后规范训练4-4练习卷(已下线)2015届辽宁省沈阳二中高三上学期10月月考试卷2015-2016学年吉林省长春第十一高中高一上期末化学试卷河北省定州中学2018届高三高中毕业班上学期期中考试化学试题【全国百强校】山东省济南市第一中学2019届高三上学期10月月考化学试题陕西省渭南中学2019届高三上学期第三次质量检测化学试题(已下线)2011-2012年江西赣州市十一县(市)高一下学期期中联考化学试卷(已下线)2013届山东省济宁市汶上一中高三上学期期中考试化学试卷福建省莆田市第二十五中学2018届高三上学期第二次月考化学试题1山东省实验中学2018届高三上学期第二次诊断考试化学试题云南省峨山彝族自治县第一中学2018届高三第四次模拟考试化学试题福建省建瓯市芝华中学2019-2020学年高二下学期第一次阶段考试化学试题浙江省东阳中学2020-2021学年高二上学期10月阶段考试化学试题
名校
解题方法
10 . 某校的化学兴趣小组利用下列实验装置探究二氧化硫的性质,已知Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,E中所装气体具有刺激性气味,能使湿润的红色石蕊试纸变蓝。
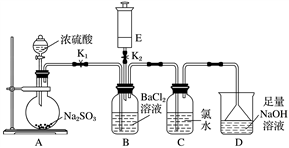
实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)B中的现象是________________ 。
(2)写出C中反应的化学方程式:_______________________________________ 。
(3)D的作用是___________________________________________________ ,
反应的离子方程式为_______________________________________________ 。
(4)A中反应完成后,关闭K1,打开K2,将E中的气体注入B中,观察到B中现象是________________________ ,
反应的离子方程式为_______________________________________________ 。

实验开始时关闭K2打开K1,从分液漏斗中向烧瓶内加入浓硫酸。
(1)B中的现象是
(2)写出C中反应的化学方程式:
(3)D的作用是
反应的离子方程式为
(4)A中反应完成后,关闭K1,打开K2,将E中的气体注入B中,观察到B中现象是
反应的离子方程式为
您最近一年使用:0次
2017-09-22更新
|
648次组卷
|
3卷引用:2018届高三一轮复习化学:考点30-硫与二氧化硫性质探究



