名校
1 . 将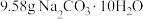 与
与 的混合物溶于水配成
的混合物溶于水配成 溶液,测得
溶液,测得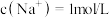 。再取同质量的混合物,加入足量的盐酸,充分加热蒸干至质量不变时,所得固体的质量为
。再取同质量的混合物,加入足量的盐酸,充分加热蒸干至质量不变时,所得固体的质量为
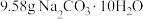 与
与 的混合物溶于水配成
的混合物溶于水配成 溶液,测得
溶液,测得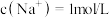 。再取同质量的混合物,加入足量的盐酸,充分加热蒸干至质量不变时,所得固体的质量为
。再取同质量的混合物,加入足量的盐酸,充分加热蒸干至质量不变时,所得固体的质量为| A.5.85g | B.7.78g | C.6.72g | D.6g |
您最近一年使用:0次
2023-10-01更新
|
42次组卷
|
3卷引用:黑龙江省齐齐哈尔市第八中学校2022-2023学年高一上学期11月期中考试化学试题
名校
解题方法
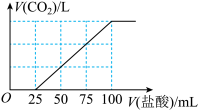
2 . 向 溶液中通入一定量的
溶液中通入一定量的 气体,充分反应后,再向所得溶液中逐滴加入
气体,充分反应后,再向所得溶液中逐滴加入 的盐酸,产生
的盐酸,产生 的体积与所加盐酸体积之间关系如图所示。下列判断正确的是
的体积与所加盐酸体积之间关系如图所示。下列判断正确的是
 溶液中通入一定量的
溶液中通入一定量的 气体,充分反应后,再向所得溶液中逐滴加入
气体,充分反应后,再向所得溶液中逐滴加入 的盐酸,产生
的盐酸,产生 的体积与所加盐酸体积之间关系如图所示。下列判断正确的是
的体积与所加盐酸体积之间关系如图所示。下列判断正确的是
A.原 溶液的浓度为 溶液的浓度为 |
B.通入的 在标准状况下的体积为 在标准状况下的体积为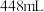 |
C.所得溶液的溶质成分的物质的量之比为 |
D.所得溶液的溶质成分的物质的量之比为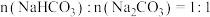 |
您最近一年使用:0次
2023-09-17更新
|
281次组卷
|
3卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题
名校
3 . 钠及其化合物在人类生产生活中有着重大的作用。某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ. 制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3
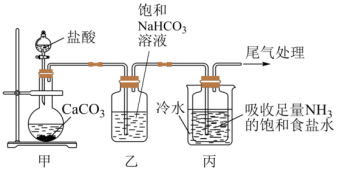
(1)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中反应的化学方程式为_________ 。
(2)用装置丙中产生的固体制取Na2CO3时,需要进行的实验操作有过滤、洗涤、灼烧,最后一步发生反应的化学方程式为_________ 。
Ⅱ. 测定产品纯度
用下图所示装置测定Na2CO3与NaHCO3固体混合物中Na2CO3的质量分数。
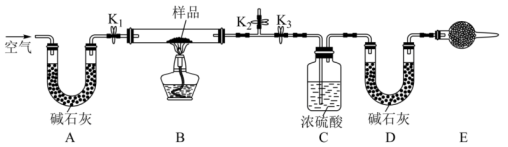
实验步骤如下:
a. 按图组装好实验装置并检查气密性;
b. 称取50g混合物放入硬质玻璃管中;称量装有碱石灰的形管的质量;
c. 打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
d. 关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
e. 打开活塞K1,缓缓鼓入空气数分钟后拆下装置,再次称量形管的质量。
(3)经测量,反应前后U形管D质量增重1.32g,样品中Na2CO3的质量分数为_________ ,若无E装置,则测得的Na2CO3的质量分数将_________ (填“偏大”“偏小”或“无影响”)。
(4)产品纯度也可以通过B装置的质量变化进行计算,称取m1g混合物放入硬质玻璃管中充分加热,反应后硬质玻璃管中固体质量为m2g,样品中Na2CO3的质量分数为_________ 。(用含m1、m2的式子表示)。
Ⅰ. 制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3

(1)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中反应的化学方程式为
(2)用装置丙中产生的固体制取Na2CO3时,需要进行的实验操作有过滤、洗涤、灼烧,最后一步发生反应的化学方程式为
Ⅱ. 测定产品纯度
用下图所示装置测定Na2CO3与NaHCO3固体混合物中Na2CO3的质量分数。

实验步骤如下:
a. 按图组装好实验装置并检查气密性;
b. 称取50g混合物放入硬质玻璃管中;称量装有碱石灰的形管的质量;
c. 打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
d. 关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
e. 打开活塞K1,缓缓鼓入空气数分钟后拆下装置,再次称量形管的质量。
(3)经测量,反应前后U形管D质量增重1.32g,样品中Na2CO3的质量分数为
(4)产品纯度也可以通过B装置的质量变化进行计算,称取m1g混合物放入硬质玻璃管中充分加热,反应后硬质玻璃管中固体质量为m2g,样品中Na2CO3的质量分数为
您最近一年使用:0次
名校
4 . 向1LNaOH溶液中通入一定量的 气体,充分反应后,再向所得溶液中逐滴加入
气体,充分反应后,再向所得溶液中逐滴加入 的盐酸,产生
的盐酸,产生 的体积与所加盐酸体积之间关系如图所示。下列判断正确的是
的体积与所加盐酸体积之间关系如图所示。下列判断正确的是
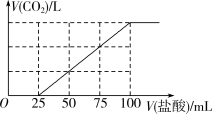
 气体,充分反应后,再向所得溶液中逐滴加入
气体,充分反应后,再向所得溶液中逐滴加入 的盐酸,产生
的盐酸,产生 的体积与所加盐酸体积之间关系如图所示。下列判断正确的是
的体积与所加盐酸体积之间关系如图所示。下列判断正确的是
A.通入的 在标准状况下的体积为448mL 在标准状况下的体积为448mL |
B.原NaOH溶液的浓度为 |
C.所得溶液的溶质成分的物质的量之比为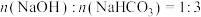 |
D.所得溶液的溶质成分的物质的量之比为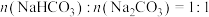 |
您最近一年使用:0次
2022-11-30更新
|
403次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学2022-2023学年高一上学期第二次阶段性考试化学试题
名校
解题方法
5 . 钠是一种非常活泼、具有广泛应用的金属。请回答:
(1)将一小块金属钠投入水中,发生反应的离子方程式是_______ ;可观察到的实验现象是_______ (填字母序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积_______ L;原混合气体的中CO2和H2O的分子数比为_______ 。
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
(1)将一小块金属钠投入水中,发生反应的离子方程式是
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
| A.取a g混合物充分加热,质量减少b g |
| B.取a g混合物与足量NaOH溶液充分反应,得到b g溶液 |
| C.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到b g固体 |
| D.取a g混合物与足量稀硫酸反应,逸出气体经干燥后用碱石灰吸收,质量增加b g |
您最近一年使用:0次
2022-11-29更新
|
531次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
6 . 下列试验方案中,不能测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是
| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量CaCl2溶液反应,过滤、洗涤、烘干得到bg固体 |
| C.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg |
| D.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
您最近一年使用:0次
名校
7 . 将一定物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50mL溶液,然后滴加盐酸与其反应,结果如图,下列说法正确的是
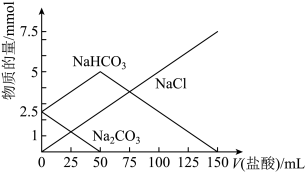

| A.标注NaCl的直线也能代表产生的CO2的物质的量的变化情况 |
| B.原混合物中Na2CO3与NaHCO3的物质的量之比为1:1 |
C.盐酸的浓度是0.05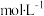 |
| D.加入的盐酸为150mL时,放出CO2气体2.24L(标准状况下) |
您最近一年使用:0次
2022-10-01更新
|
177次组卷
|
2卷引用:黑龙江省佳木斯市汤原县高级中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
8 . 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。

下列判断正确的是

下列判断正确的是
| A.原NaOH溶液的浓度为0.2mol•L-1 |
| B.通入的CO2在标准状况下的体积为448mL |
| C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3 |
| D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶2 |
您最近一年使用:0次
2022-08-26更新
|
282次组卷
|
8卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题
黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题(已下线)第04练 钠及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)天津市新华中学2022-2023学年高三上学期学科练习(一)化学试题江西省丰城中学2022-2023学年高三上学期月考化学试题云南省富宁县第一中学2021-2022学年高一下学期开学考试化学试题湖北省武汉海淀外国语实验学校2022-2023学年高三上学期10月月考化学试题黑龙江省七台河市勃利县高级中学2023-2024学年高三上学期9月月考化学试题
名校
解题方法
9 . 下列说法正确的是
①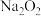 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②质量相等的 与
与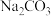 分别与足量相同浓度盐酸完全反应时,产生
分别与足量相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;
③取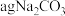 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定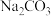 和
和 混合物中
混合物中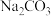 质量分数;
质量分数;
④区别 与
与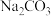 溶液,可用
溶液,可用 溶液;
溶液;
⑤ 固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑥ 粉末中混有
粉末中混有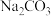 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶提纯得到。
,再低温结晶提纯得到。
①
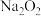 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;②质量相等的
 与
与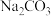 分别与足量相同浓度盐酸完全反应时,产生
分别与足量相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;③取
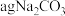 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定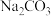 和
和 混合物中
混合物中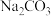 质量分数;
质量分数;④区别
 与
与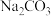 溶液,可用
溶液,可用 溶液;
溶液;⑤
 固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
固体可以做干粉灭火剂,金属钠起火可以用它来灭火;⑥
 粉末中混有
粉末中混有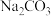 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶提纯得到。
,再低温结晶提纯得到。| A.②④ | B.②⑤ | C.①⑥ | D.③④ |
您最近一年使用:0次
2022-08-25更新
|
251次组卷
|
15卷引用:黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题
黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题(已下线)第08练 钠及其化合物-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)(已下线)衔接点15 钠的化合物-2022年初升高化学无忧衔接?黑龙江省饶河县高级中学2021-2022学年高一上学期期中考试化学试题山东省威海乳山市银滩高级中学2022-2023学年高一10月第二次考试化学试题甘肃省兰州市西北师范大学附属中学2022-2023学年高三上学期期中考试化学试题安徽省蚌埠市第二中学2020-2021学年高一上学期期中考试化学(理科)试题河南省镇平县第一高级中学2020-2021学年高一上学期第二次月考化学试题湖北省沙市中学2021-2022学年高一上学期期中考试化学试题天津市耀华中学2021-2022学年高一上学期期中考试化学试题(已下线)必考点07 钠盐及焰色试验-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)江西省宜春市万载中学2021-2022学年高一上学期第三次月考化学试题江西省丰城中学2023-2024学年高三上学期开学考试化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题天津市第二十中学2023-2024学年高一上学期期中考试化学试题
名校
10 . 完成下列问题。
(1)现有8种物质:① ②
② ③浓硫酸④铝⑤
③浓硫酸④铝⑤ 胶体⑥蔗糖溶液⑦
胶体⑥蔗糖溶液⑦ ⑧
⑧ 。上述物质中属于电解质的有
。上述物质中属于电解质的有_______ (选填序号);写出②的溶液与⑤反应的离子方程式_______
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,研究人员提出,在碱性条件下可以用铝粉处理
的浓度,研究人员提出,在碱性条件下可以用铝粉处理 ,发生反应的化学方程式为:
,发生反应的化学方程式为: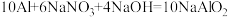
 ,该反应中,还原剂为
,该反应中,还原剂为_______ ,若反应过程中转移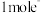 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为_______  。
。
(3)在含有一定量 和
和 溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生
溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生 的物质的量与滴入盐酸的量的关系如图,回答下列问题:
的物质的量与滴入盐酸的量的关系如图,回答下列问题:
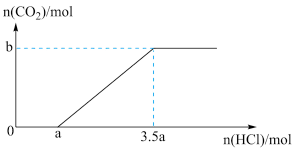
①0→a点发生反应的离子方程式为_______
② 与
与 物质的量之比为
物质的量之比为_______
③b=_______ (用含a的代数式表示)
(1)现有8种物质:①
 ②
② ③浓硫酸④铝⑤
③浓硫酸④铝⑤ 胶体⑥蔗糖溶液⑦
胶体⑥蔗糖溶液⑦ ⑧
⑧ 。上述物质中属于电解质的有
。上述物质中属于电解质的有(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,研究人员提出,在碱性条件下可以用铝粉处理
的浓度,研究人员提出,在碱性条件下可以用铝粉处理 ,发生反应的化学方程式为:
,发生反应的化学方程式为: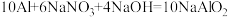
 ,该反应中,还原剂为
,该反应中,还原剂为 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为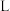 。
。(3)在含有一定量
 和
和 溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生
溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生 的物质的量与滴入盐酸的量的关系如图,回答下列问题:
的物质的量与滴入盐酸的量的关系如图,回答下列问题:
①0→a点发生反应的离子方程式为
②
 与
与 物质的量之比为
物质的量之比为③b=
您最近一年使用:0次



