名校
1 . 按要求回答下列问题:
(1)现有以下物质:①Cl2②CO2③Na2O④NaHSO4⑤漂白粉⑥NaOH溶液⑦Ba(OH)2,其中属于酸性氧化物的有
(2)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
(3)下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 | A | B | C | D | E | F | G |
原子半径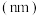 | 0.186 | 0.160 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
①七种元素的最高价氧化物的水化物中,酸性最强的是
②B、E、G的离子半径由大到小的顺序是
③元素G的最简单氢化物的结构式
(4)200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2充分反应后,得到Na2CO3和NaHCO3的混合溶液,向上述所得溶液中,逐滴加入2mol/L的盐酸,所得气体的体积与所加盐酸的体积关系如图所示(不考虑体积变化):
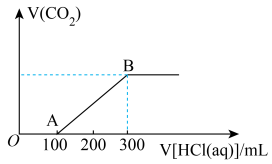
B点时,反应所得溶液中溶质的物质的量浓度是
(5)向浑浊的水中加入明矾(KAl(SO4)2·12H2O)后,水可得到净化。写出硫酸铝钾在水中的电离方程式:
您最近半年使用:0次
名校
解题方法
2 . 将一定量 缓慢通入某浓度的NaOH溶液充分反应得A溶液,向A溶液中逐滴滴入稀盐酸,加入
缓慢通入某浓度的NaOH溶液充分反应得A溶液,向A溶液中逐滴滴入稀盐酸,加入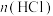 与生成
与生成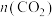 的关系如图所示。下列有关叙述正确的是
的关系如图所示。下列有关叙述正确的是
 缓慢通入某浓度的NaOH溶液充分反应得A溶液,向A溶液中逐滴滴入稀盐酸,加入
缓慢通入某浓度的NaOH溶液充分反应得A溶液,向A溶液中逐滴滴入稀盐酸,加入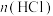 与生成
与生成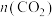 的关系如图所示。下列有关叙述正确的是
的关系如图所示。下列有关叙述正确的是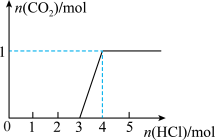
A.通入的 气体为22.4L 气体为22.4L |
B.A溶液中 |
C.A溶液中既含 ,又含 ,又含 |
D.图中产生 气体的反应为: 气体的反应为: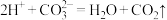 |
您最近半年使用:0次
2024-03-17更新
|
113次组卷
|
4卷引用:黑龙江省哈尔滨师范大学附属中学2023-2024学年高一下学期开学摸底考试化学试卷
3 . 金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题:
(1)经检测某酸性废水中所含离子及其浓度如表所示:
则c(Al3+)=___________ mol/L。
(2)已知Fe(NO3)3的高纯度结晶体是一种紫色潮解性固体,适用于制备磁性氧化铁纳米粉末。写出磁性氧化铁与足量稀硝酸反应的离子方程式:___________ 。
(3)用托盘天平(1g以下用游码)称量绿矾(FeSO4·7H2O)晶体配制450mL0.1mol/L溶液,以下实验操作会导致所配溶液浓度偏低的是___________ 。
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻线,未补加水
d.定容时,俯视刻度线
(4)8.34 g绿矾(FeSO4·7H2O)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:

温度为159 ℃时固体N的化学式为___________ ,取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种红棕色固体物质Q,同时有两种无色气体生成,请写出该反应的化学方程式___________ 。
(5)钠的化合物广泛应用于工业生产。
①NaH能与水剧烈反应,反应方程式为NaH+H2O=NaOH+H2↑,NaH与液氨也有类似的反应,请写出NaH与液氨反应的化学方程式___________ 。
②现有由两种含钠化合物组成的混合物,溶于水后,逐滴加入某浓度盐酸,所得CO2的粒子数目与所耗HCl的粒子数目关系如图,两种含钠化合物的化学式及物质的量之比为___________ 。

(1)经检测某酸性废水中所含离子及其浓度如表所示:
| 离子 | Fe3+ | Al3+ | SO | NO | H+ |
| 浓度(mol/L) | 2×10-2 | 1×10-1 | 2×10-2 | 1×10-1 |
(2)已知Fe(NO3)3的高纯度结晶体是一种紫色潮解性固体,适用于制备磁性氧化铁纳米粉末。写出磁性氧化铁与足量稀硝酸反应的离子方程式:
(3)用托盘天平(1g以下用游码)称量绿矾(FeSO4·7H2O)晶体配制450mL0.1mol/L溶液,以下实验操作会导致所配溶液浓度偏低的是
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻线,未补加水
d.定容时,俯视刻度线
(4)8.34 g绿矾(FeSO4·7H2O)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:

温度为159 ℃时固体N的化学式为
(5)钠的化合物广泛应用于工业生产。
①NaH能与水剧烈反应,反应方程式为NaH+H2O=NaOH+H2↑,NaH与液氨也有类似的反应,请写出NaH与液氨反应的化学方程式
②现有由两种含钠化合物组成的混合物,溶于水后,逐滴加入某浓度盐酸,所得CO2的粒子数目与所耗HCl的粒子数目关系如图,两种含钠化合物的化学式及物质的量之比为

您最近半年使用:0次
名校
4 . NaHCO3溶液不仅在受热时能分解放出CO2,而且在室温时亦能分解。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。___________ 。
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性___________ (填“强”或“弱”)。
③0.5 mol·L-1 Na2CO3溶液的pH=___________ 。
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。___________ 。
②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为___________ 。
③实验结果偏低的原因是___________ 。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。
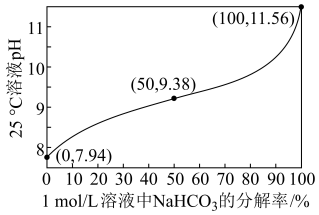
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性
③0.5 mol·L-1 Na2CO3溶液的pH=
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。

②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为
③实验结果偏低的原因是
您最近半年使用:0次
2024-01-17更新
|
112次组卷
|
2卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
5 . 下列选项描述与对应图像相符的是
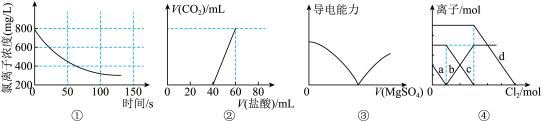
| A.图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像 |
| B.图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像 |
| C.图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像 |
| D.图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl-(已知还原性:I->Fe2+>Br-) |
您最近半年使用:0次
2023-12-21更新
|
689次组卷
|
13卷引用:黑龙江省大庆铁人中学2023-2024学年高一上学期期中考试化学试卷
黑龙江省大庆铁人中学2023-2024学年高一上学期期中考试化学试卷黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题浙江省台州市2022-2023学年高一上学期期末质量评估化学试题辽宁省东北育才学校2024届高三上学期高中学段联合考试化学试题甘肃省兰州第一中学2023-2024学年高一上学期11月期中考试化学试题吉林省吉林市第一中学2023--2024学年高一上学期第一次月考化学试题(创新班)山西省大同市2023-2024学年高一上学期12月月考化学试题吉林省延边第一中学2023-2024学年高三上学期第二次模考化学试题陕西省西安市长安区第一中学2023-2024学年高三上学期第二次教学质量检测化学试题北京市首都师范大学附属中学2023-2024学年高一上学期期末考试化学试题安徽省合肥市第一中学肥东分校2023-2024学年高一上学期期末考试化学试卷四川省眉山市仁寿第一中学校南校区2023-2024学年高一下学期开学化学试题山西省吕梁市孝义市联考2023-2024学年高一上学期12月月考化学试题
名校
6 . 取一定量 溶液通入
溶液通入 后,再继续向该溶液中逐滴加入
后,再继续向该溶液中逐滴加入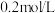 的盐酸,产生
的盐酸,产生 的体积(标准状况)与所加盐酸体积之间的关系如图所示,下列说法正确的是
的体积(标准状况)与所加盐酸体积之间的关系如图所示,下列说法正确的是
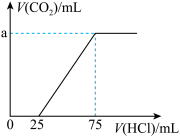
 溶液通入
溶液通入 后,再继续向该溶液中逐滴加入
后,再继续向该溶液中逐滴加入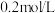 的盐酸,产生
的盐酸,产生 的体积(标准状况)与所加盐酸体积之间的关系如图所示,下列说法正确的是
的体积(标准状况)与所加盐酸体积之间的关系如图所示,下列说法正确的是
A.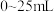 段发生反应的离子方程式为 段发生反应的离子方程式为 |
B.通入 后所得的溶液溶质成分为 后所得的溶液溶质成分为 和 和 ,其物质的量比为 ,其物质的量比为 |
C.原溶液中 的物质的量为 的物质的量为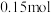 |
D. |
您最近半年使用:0次
名校
解题方法
7 . 下列实验方案中,不能测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是
| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg |
| D.取ag混合物与足量NaOH溶液充分反应,得到bg固体 |
您最近半年使用:0次
名校
8 . 短周期元素X、Y、Z原子序数依次增大,其中Y元素的一种同位素可用于文物年代的断定,且其最外层电子数等于X、Z最外层电子总和的一半。Y、Z可形成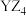 型化合物且分子中每个原子均满足8电子稳定结构。关于三种元素的价类二维图如下所示:
型化合物且分子中每个原子均满足8电子稳定结构。关于三种元素的价类二维图如下所示:

注:△、□、○分别表示X、Y、Z形成的化合物。回答下列问题:
(1) 与水反应生成氢气的化学方程式为
与水反应生成氢气的化学方程式为_______ ;
(2)X在空气中燃烧可获得4,而与X相邻的同主族金属元素Q在空气中燃烧可获得_______ (填化学式),由此可以判断,X、Q金属性较强的是_______ (填元素符号);
(3)向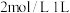 的NaOH溶液中通入a mol
的NaOH溶液中通入a mol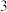 可获得含溶质
可获得含溶质 的溶液,若
的溶液,若 是两种盐的混合物,则a的取值范围是
是两种盐的混合物,则a的取值范围是_______ mol,不使用其它试剂,可将固体 转化为纯净物的化学反应为
转化为纯净物的化学反应为_______ (写化学方程式);
(4)用合适的方程式证明 的酸性强于⑥
的酸性强于⑥_______ ,依据该事实_______ (填“能”或“不能”)判断出Y、Z的非金属性强弱,理由是_______ 。
 型化合物且分子中每个原子均满足8电子稳定结构。关于三种元素的价类二维图如下所示:
型化合物且分子中每个原子均满足8电子稳定结构。关于三种元素的价类二维图如下所示:
注:△、□、○分别表示X、Y、Z形成的化合物。回答下列问题:
(1)
 与水反应生成氢气的化学方程式为
与水反应生成氢气的化学方程式为(2)X在空气中燃烧可获得4,而与X相邻的同主族金属元素Q在空气中燃烧可获得
(3)向
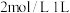 的NaOH溶液中通入a mol
的NaOH溶液中通入a mol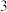 可获得含溶质
可获得含溶质 的溶液,若
的溶液,若 是两种盐的混合物,则a的取值范围是
是两种盐的混合物,则a的取值范围是 转化为纯净物的化学反应为
转化为纯净物的化学反应为(4)用合适的方程式证明
 的酸性强于⑥
的酸性强于⑥
您最近半年使用:0次
2023-12-14更新
|
228次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学校2023-2024学年高一上学期12月测试化学试题
名校
解题方法
9 . 向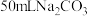 和
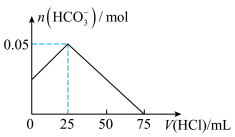
和 混合溶液中缓慢滴加一定浓度的盐酸,测得溶液中
混合溶液中缓慢滴加一定浓度的盐酸,测得溶液中 物质的量与所加盐酸体积之间的关系如图所示。
物质的量与所加盐酸体积之间的关系如图所示。
请回答下列问题:
(1)加盐酸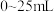 过程中发生反应的离子方程式为:
过程中发生反应的离子方程式为:___________ 。
(2)盐酸物质的量浓度为___________  ,原混合溶液中
,原混合溶液中 的物质的量浓度为
的物质的量浓度为___________  。
。
(3)当滴入的盐酸体积为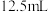 时,溶液中
时,溶液中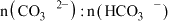 为
为___________ 。
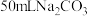 和
和 混合溶液中缓慢滴加一定浓度的盐酸,测得溶液中
混合溶液中缓慢滴加一定浓度的盐酸,测得溶液中 物质的量与所加盐酸体积之间的关系如图所示。
物质的量与所加盐酸体积之间的关系如图所示。
请回答下列问题:
(1)加盐酸
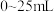 过程中发生反应的离子方程式为:
过程中发生反应的离子方程式为:(2)盐酸物质的量浓度为
 ,原混合溶液中
,原混合溶液中 的物质的量浓度为
的物质的量浓度为 。
。(3)当滴入的盐酸体积为
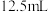 时,溶液中
时,溶液中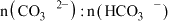 为
为
您最近半年使用:0次
2023-11-27更新
|
243次组卷
|
3卷引用:黑龙江省哈尔滨市2023-2024学年师大附中高一上学期化学期中测试
名校
解题方法
10 . 某食品膨松剂起作用物质为NaHCO3,某兴趣小组研究加热情况下该膨松剂放出气体的量,设计实验的装置图如图。
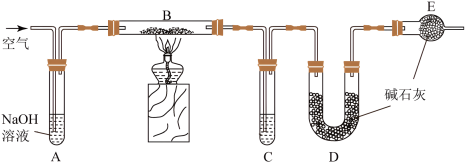
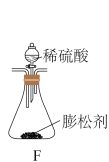
回答下列问题:
(1)A装置中NaOH溶液的作用是除去空气中的_______ ,C装置内所盛试剂是_______ ,E装置的作用是_______ ,若没有E装置,测定的结果_______ (填“偏高”、“偏低”或“无影响”);若没有A装置,B装置左侧用橡皮塞封闭,实验结果将_______ (填“偏高”、“偏低”或“无影响”)。
(2)分解产物Na2CO3是重要化工原料,研究其性质:分别取少量Na2CO3溶液。
①与碱反应:滴加澄清石灰水,现象为_______ 。
②与盐反应:滴加X溶液,产生白色沉淀,则X可能为_______ (写其中一种的名称)。
③与酸反应:滴加盐酸,开始没有气泡,反应产生两种盐,推测两种盐的化学式_______ 。
(3)取a克Na2CO3与NaHCO3混合物进行下列三组实验,其中能测定Na2CO3质量分数的是_______ (填序号)。
A.充分加热,质量减少b克
B.与足量稀盐酸充分反应,加热、蒸干,灼烧,得b克固体
C.与足量稀硫酸充分反应,逸出气体用氯化钙吸收,增重b克
任选上述合理方案中的一种,计算Na2CO3的质量分数为_______ 。


回答下列问题:
(1)A装置中NaOH溶液的作用是除去空气中的
(2)分解产物Na2CO3是重要化工原料,研究其性质:分别取少量Na2CO3溶液。
①与碱反应:滴加澄清石灰水,现象为
②与盐反应:滴加X溶液,产生白色沉淀,则X可能为
③与酸反应:滴加盐酸,开始没有气泡,反应产生两种盐,推测两种盐的化学式
(3)取a克Na2CO3与NaHCO3混合物进行下列三组实验,其中能测定Na2CO3质量分数的是
A.充分加热,质量减少b克
B.与足量稀盐酸充分反应,加热、蒸干,灼烧,得b克固体
C.与足量稀硫酸充分反应,逸出气体用氯化钙吸收,增重b克
任选上述合理方案中的一种,计算Na2CO3的质量分数为
您最近半年使用:0次



