名校
1 . NaHCO3溶液不仅在受热时能分解放出CO2,而且在室温时亦能分解。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。___________ 。
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性___________ (填“强”或“弱”)。
③0.5 mol·L-1 Na2CO3溶液的pH=___________ 。
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。___________ 。
②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为___________ 。
③实验结果偏低的原因是___________ 。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。
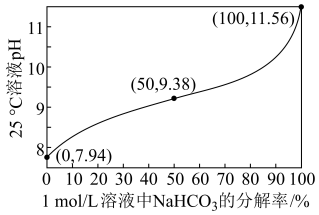
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性
③0.5 mol·L-1 Na2CO3溶液的pH=
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。

②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为
③实验结果偏低的原因是
您最近一年使用:0次
2024-01-17更新
|
115次组卷
|
2卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
2 . 下列选项描述与对应图像相符的是
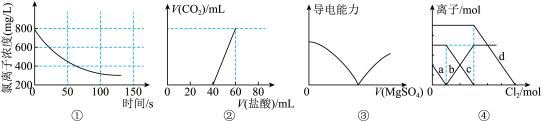
| A.图①为新制氯水在阳光直射时,溶液中Cl-浓度随着时间变化的图像 |
| B.图②为Na2CO3、NaHCO3混合液中滴加盐酸产生CO2的图像 |
| C.图③为向Ba(OH)2溶液中滴加MgSO4溶液的导电性变化图像 |
| D.图④为FeBr2、FeI2混合液中各离子物质的量随氯气通入的变化图像,曲线b代表的是Cl-(已知还原性:I->Fe2+>Br-) |
您最近一年使用:0次
2023-12-21更新
|
702次组卷
|
13卷引用:黑龙江省大庆铁人中学2023-2024学年高一上学期期中考试化学试卷
黑龙江省大庆铁人中学2023-2024学年高一上学期期中考试化学试卷黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题浙江省台州市2022-2023学年高一上学期期末质量评估化学试题辽宁省东北育才学校2024届高三上学期高中学段联合考试化学试题甘肃省兰州第一中学2023-2024学年高一上学期11月期中考试化学试题吉林省吉林市第一中学2023--2024学年高一上学期第一次月考化学试题(创新班)山西省大同市2023-2024学年高一上学期12月月考化学试题吉林省延边第一中学2023-2024学年高三上学期第二次模考化学试题陕西省西安市长安区第一中学2023-2024学年高三上学期第二次教学质量检测化学试题北京市首都师范大学附属中学2023-2024学年高一上学期期末考试化学试题安徽省合肥市第一中学肥东分校2023-2024学年高一上学期期末考试化学试卷四川省眉山市仁寿第一中学校南校区2023-2024学年高一下学期开学化学试题山西省吕梁市孝义市联考2023-2024学年高一上学期12月月考化学试题
名校
解题方法
3 . 碳酸钠是一种重要的化工原料,在生产、生活和实验研究中均有广泛应用。下面是与碳酸钠溶液相关问题的探讨,请按要求回答问题。
(1)实验室需配制240 mL 1.5 mol/LNa2CO3溶液,请回答下列问题:
①实验中除了用到托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有_______ 。
②通过计算可知,该实验需要用托盘天平称量_______ g Na2CO3·10H2O。
③经测定实际配得溶液的浓度为1.4 mol/L,原因不可能_______ (填序号)。
a.转移溶液前容量瓶内有少量蒸馏水 b.定容摇匀后,发现液面下降,继续加水至刻度线
c.转移溶液后未洗涤烧杯 d.定容时俯视刻度线
(2)FeCO3与砂糖混用可以作补血剂,工业上用Na2CO3溶液和FeSO4溶液发生复分解反应制备。(已知溶液pH大于8.8时,Fe2+转化为Fe(OH)2沉淀,实验中所用Na2CO3溶液的pH=10)。
①在烧杯中混合上述溶液制备 FeCO3沉淀时的具体操作为_______ 。
②将FeSO4溶液缓慢加入到盛有NaHCO3溶液的烧杯中也能得到FeCO3沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为_______ 。
(3)某同学在常温下,向100 mL NaOH溶液中通入一定量的CO2气体制备Na2CO3溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3 mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。请你帮他仔细分析实验结果。
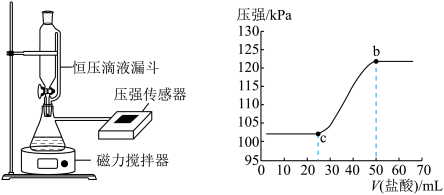
①该同学所得溶液的溶质成分为_______ 。
②该同学使用的NaOH溶液的物质的量浓度不低于_______ mol/L
(1)实验室需配制240 mL 1.5 mol/LNa2CO3溶液,请回答下列问题:
①实验中除了用到托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有
②通过计算可知,该实验需要用托盘天平称量
③经测定实际配得溶液的浓度为1.4 mol/L,原因不可能
a.转移溶液前容量瓶内有少量蒸馏水 b.定容摇匀后,发现液面下降,继续加水至刻度线
c.转移溶液后未洗涤烧杯 d.定容时俯视刻度线
(2)FeCO3与砂糖混用可以作补血剂,工业上用Na2CO3溶液和FeSO4溶液发生复分解反应制备。(已知溶液pH大于8.8时,Fe2+转化为Fe(OH)2沉淀,实验中所用Na2CO3溶液的pH=10)。
①在烧杯中混合上述溶液制备 FeCO3沉淀时的具体操作为
②将FeSO4溶液缓慢加入到盛有NaHCO3溶液的烧杯中也能得到FeCO3沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为
(3)某同学在常温下,向100 mL NaOH溶液中通入一定量的CO2气体制备Na2CO3溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3 mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。请你帮他仔细分析实验结果。

①该同学所得溶液的溶质成分为
②该同学使用的NaOH溶液的物质的量浓度不低于
您最近一年使用:0次
名校
解题方法
4 . 下列实验方案中,不能测定出 和
和 的混合物中
的混合物中 质量分数的是
质量分数的是
 和
和 的混合物中
的混合物中 质量分数的是
质量分数的是A.取ag混合物与足量 溶液充分反应,过滤、洗涤、干燥,得到bg固体 溶液充分反应,过滤、洗涤、干燥,得到bg固体 |
| B.取ag混合物充分加热,质量减少bg |
| C.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg |
您最近一年使用:0次
2022-07-12更新
|
1076次组卷
|
8卷引用:黑龙江省双鸭山市第一中学2022-2023学年高三上学期开学考试化学试题
黑龙江省双鸭山市第一中学2022-2023学年高三上学期开学考试化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题重庆第二外国语学校2021-2022学年高一上学期期末考试化学试题重庆市主城区六校2021-2022学年高一上学期期末联考化学试题(已下线)卷03 阿伏伽德罗常数有关计算-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)天津市和平区2021-2022学年高一下学期高中学业水平合格性模拟考试化学试题河南省濮阳市2021-2022学年高一下学期学业质量检测(期末)化学试卷四川省内江市资中县第二中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
5 . 向100 mL NaOH溶液中通入一定量的CO2气体,经充分反应后,再向所获得的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断不正确的是
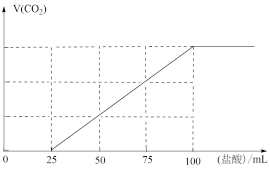

| A.原NaOH溶液的物质的量浓度为0.1 mol·L-1 |
| B.通入CO2的体积为224 mL |
C.V(盐酸)=0~25 mL的范围内发生的离子反应为:CO +H+=HCO +H+=HCO |
| D.所得溶液的溶质成分为Na2CO3和NaHCO3且物质的量之比为1∶2 |
您最近一年使用:0次
名校
6 . 下列试验方案中,不能测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是
| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量CaCl2溶液反应,过滤、洗涤、烘干得到bg固体 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg |
您最近一年使用:0次
2021-12-04更新
|
1011次组卷
|
7卷引用:黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题
黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题湖南省石门县第一中学2021-2022学年高一上学期期中段考化学试题(已下线)专题36 碳酸钠质量分数测定的实验探究-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江西省宜春市铜鼓中学2021-2022学年高一下学期开学考化学试题陕西省西安中学 2023 届高三上学期第二次质量检测化学试题河南省顶级名校2023届高三上学期10月月考化学试题宁夏回族自治区银川一中2023-2024学年高一上学期期中考试化学试题
名校
7 . 纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)实验室中需0.2mol/L的 溶液980mL,配制时应选用容量瓶的规格和称取
溶液980mL,配制时应选用容量瓶的规格和称取 的质量分别是_______。
的质量分别是_______。
(2)碳酸钠和碳酸氢钠的鉴别与稳定性探究。
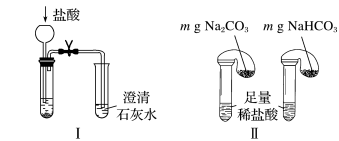
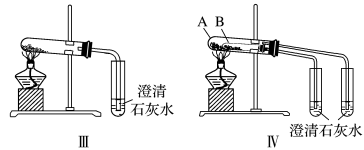
①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是_______ (填装置序号)。
②图Ⅲ、Ⅳ中_______ 能更好说明二者的稳定性(填装置序号)。Ⅳ中受热处发生反应的化学方程式:_______ 。
(3)利用图Ⅲ的装置加热 和
和 的混合物,剩余固体成分会随二者物质的量不同而发生变化。当
的混合物,剩余固体成分会随二者物质的量不同而发生变化。当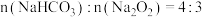 充分混合后,加热至完全反应,试管内剩余的固体是
充分混合后,加热至完全反应,试管内剩余的固体是_______ (填化学式)。
(1)实验室中需0.2mol/L的
 溶液980mL,配制时应选用容量瓶的规格和称取
溶液980mL,配制时应选用容量瓶的规格和称取 的质量分别是_______。
的质量分别是_______。| A.500mL;21.2g | B.900mL;20.1g | C.1000mL;20.1g | D.1000mL;21.2g |


①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是
②图Ⅲ、Ⅳ中
(3)利用图Ⅲ的装置加热
 和
和 的混合物,剩余固体成分会随二者物质的量不同而发生变化。当
的混合物,剩余固体成分会随二者物质的量不同而发生变化。当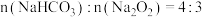 充分混合后,加热至完全反应,试管内剩余的固体是
充分混合后,加热至完全反应,试管内剩余的固体是
您最近一年使用:0次
2021-12-02更新
|
444次组卷
|
2卷引用:黑龙江省大庆实验中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
8 . 向四只盛有一定量 溶液的烧杯中,分别通入不同量的
溶液的烧杯中,分别通入不同量的 气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的
气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的 气体与
气体与 的量的关系如图所示(忽略
的量的关系如图所示(忽略 的溶解和
的溶解和 的挥发,n代表物质的个数)则下列分析不正确的是
的挥发,n代表物质的个数)则下列分析不正确的是

 溶液的烧杯中,分别通入不同量的
溶液的烧杯中,分别通入不同量的 气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的
气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的 气体与
气体与 的量的关系如图所示(忽略
的量的关系如图所示(忽略 的溶解和
的溶解和 的挥发,n代表物质的个数)则下列分析不正确的是
的挥发,n代表物质的个数)则下列分析不正确的是
A.Ⅰ图对应溶液中溶质为 |
B.Ⅱ图对应溶液中溶质为 |
C.Ⅲ图对应溶液中溶质为 和 和 ,且 ,且 和 和 的个数比为1:2 的个数比为1:2 |
D.Ⅳ图对应溶液中溶质为 和 和 ,且 ,且 和 和 的个数比为1:1 的个数比为1:1 |
您最近一年使用:0次
2021-11-14更新
|
1094次组卷
|
3卷引用:黑龙江省大庆铁人中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
9 . 取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是
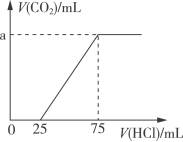

| A.原溶液中NaOH的物质的量为0.75mol |
| B.通入CO2后所得的溶液溶质成分为NaOH和Na2CO3 |
| C.通入CO2后所得的溶液中含有2.5×10-3molNaHCO3 |
| D.原溶液通入CO2标准状况下为224mL |
您最近一年使用:0次
2021-09-16更新
|
1337次组卷
|
5卷引用:黑龙江宾县第一中学2020-2021学年高一上学期第二次月考化学试题
黑龙江宾县第一中学2020-2021学年高一上学期第二次月考化学试题吉林省通榆县第一中学2021届高三上学期第二次月考化学试题(已下线)微项目 探秘膨松剂-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)广东省普宁市华侨中学2021—2022学年高一上学期第三次月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高一10月第二次考试化学试题
名校
解题方法
10 . 向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是
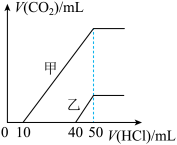

| A.乙溶液中含有的溶质是Na2CO3、NaHCO3 |
| B.当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为OH-+H+ =H2O |
| C.原NaOH溶液的物质的量浓度为0.5mol·L-1 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
您最近一年使用:0次
2021-05-28更新
|
2596次组卷
|
25卷引用:黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题
黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题(已下线)2014届安徽省“江淮十校”协作体高三上学期第一次联考化学试卷2016届山东省威海市乳山市高三上学期期中测试化学试卷2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷2017届河北省涞水县波峰中学高三8月月考化学试卷河南省豫南豫北名校2018届高三精英联赛化学试题1陕西省陕师大附中2018届高三第五次月考化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2【全国百强校】天津市第一中学2019届高三上学期第一次月考化学试题【全国百强校】甘肃省天水市第一中学2019届高三上学期一轮复习第二次质量检测化学试题【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高一上学期第二次月考化学试题(已下线)2019年1月14日 《每日一题》高考二轮复习-钠及其化合物上海市十二校2015届高三12月联考化学试题天津一中2020届高三第二次月考化学试题福建省福州市第三中学2020-2021学年高三上学期第二次质量检测化学试题河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)广东省广州市三校2021-202学年高一上学期期末联考化学试题(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省南充高级中学2021-2022学年高一下学期开学考试化学试题陕西师范大学附属中学2023-2024学年高一上学期期中考试化学试题湖北省荆州市荆州中学2023-2024学年高一上学期期末考试化学试题



