名校
1 . 完成下列问题。
(1)现有8种物质:① ②
② ③浓硫酸④铝⑤
③浓硫酸④铝⑤ 胶体⑥蔗糖溶液⑦
胶体⑥蔗糖溶液⑦ ⑧
⑧ 。上述物质中属于电解质的有
。上述物质中属于电解质的有_______ (选填序号);写出②的溶液与⑤反应的离子方程式_______
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,研究人员提出,在碱性条件下可以用铝粉处理
的浓度,研究人员提出,在碱性条件下可以用铝粉处理 ,发生反应的化学方程式为:
,发生反应的化学方程式为: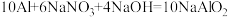
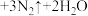 ,该反应中,还原剂为
,该反应中,还原剂为_______ ,若反应过程中转移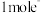 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为_______  。
。
(3)在含有一定量 和
和 溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生
溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生 的物质的量与滴入盐酸的量的关系如图,回答下列问题:
的物质的量与滴入盐酸的量的关系如图,回答下列问题:
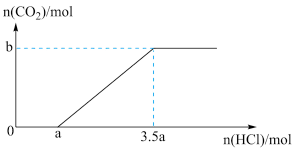
①0→a点发生反应的离子方程式为_______
② 与
与 物质的量之比为
物质的量之比为_______
③b=_______ (用含a的代数式表示)
(1)现有8种物质:①
 ②
② ③浓硫酸④铝⑤
③浓硫酸④铝⑤ 胶体⑥蔗糖溶液⑦
胶体⑥蔗糖溶液⑦ ⑧
⑧ 。上述物质中属于电解质的有
。上述物质中属于电解质的有(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,研究人员提出,在碱性条件下可以用铝粉处理
的浓度,研究人员提出,在碱性条件下可以用铝粉处理 ,发生反应的化学方程式为:
,发生反应的化学方程式为: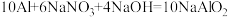
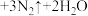 ,该反应中,还原剂为
,该反应中,还原剂为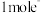 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为 。
。(3)在含有一定量
 和
和 溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生
溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生 的物质的量与滴入盐酸的量的关系如图,回答下列问题:
的物质的量与滴入盐酸的量的关系如图,回答下列问题:
①0→a点发生反应的离子方程式为
②
 与
与 物质的量之比为
物质的量之比为③b=
您最近一年使用:0次
名校
2 . I、某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题,可供选择的试剂有:A.大理石 B.盐酸 C.氢氧化钠溶液 D.澄清石灰水
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液 Na2CO3溶液
Na2CO3溶液
乙:NaOH溶液 NaHCO3溶液
NaHCO3溶液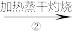 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液
丙:NaOH溶液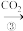 NaHCO3溶液
NaHCO3溶液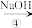 Na2CO3溶液
Na2CO3溶液
请回答下列问题:
(1)___________ 方案最优,其实验的关键是:_________ 。
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学___________ (填“能”或“不能”)达到实验目的;若能,请说明计算所需的数据;若不能,请简要说明理由:___________ 。
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需___________ g的NaOH固体;实验中用到的玻璃仪器除了烧杯、玻璃棒、胶头滴管、量筒、试剂瓶,还需要___________ 。
(4)下列实验步骤,正确的操作顺序是:___________ 。
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将___________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中用滤纸称量固体,所配溶液的浓度将___________ ;如果上述C操作中目光俯视,所配溶液的浓度将___________ 。
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液
 Na2CO3溶液
Na2CO3溶液乙:NaOH溶液
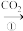 NaHCO3溶液
NaHCO3溶液 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液丙:NaOH溶液
 NaHCO3溶液
NaHCO3溶液 Na2CO3溶液
Na2CO3溶液请回答下列问题:
(1)
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需
(4)下列实验步骤,正确的操作顺序是:
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将
您最近一年使用:0次
名校
解题方法
3 . 向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是
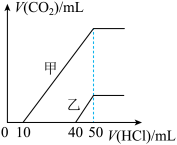

| A.乙溶液中含有的溶质是Na2CO3、NaHCO3 |
| B.当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为OH-+H+ =H2O |
| C.原NaOH溶液的物质的量浓度为0.5mol·L-1 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
您最近一年使用:0次
2021-05-28更新
|
2597次组卷
|
25卷引用:黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题
黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题(已下线)2014届安徽省“江淮十校”协作体高三上学期第一次联考化学试卷2016届山东省威海市乳山市高三上学期期中测试化学试卷2017届河北省涞水县波峰中学高三8月月考化学试卷河南省豫南豫北名校2018届高三精英联赛化学试题1陕西省陕师大附中2018届高三第五次月考化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2【全国百强校】天津市第一中学2019届高三上学期第一次月考化学试题【全国百强校】甘肃省天水市第一中学2019届高三上学期一轮复习第二次质量检测化学试题【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高一上学期第二次月考化学试题(已下线)2019年1月14日 《每日一题》高考二轮复习-钠及其化合物上海市十二校2015届高三12月联考化学试题天津一中2020届高三第二次月考化学试题福建省福州市第三中学2020-2021学年高三上学期第二次质量检测化学试题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)广东省广州市三校2021-202学年高一上学期期末联考化学试题(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省南充高级中学2021-2022学年高一下学期开学考试化学试题陕西师范大学附属中学2023-2024学年高一上学期期中考试化学试题湖北省荆州市荆州中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
4 . 向NaOH和Na2CO3混合溶液中滴加1 mol/L的稀盐酸,CO2的生成量与加入盐酸的量的关系如图所示。下列判断正确的是
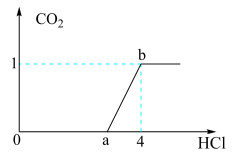

| A.在0~a范围内,只发生中和反应 |
B.ab段发生反应的离子方程式为CO +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| C.a=3 |
| D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2 |
您最近一年使用:0次
2020-11-23更新
|
2854次组卷
|
67卷引用:黑龙江省大庆市铁人中学2018-2019学年高二下学期期末考试化学试题
黑龙江省大庆市铁人中学2018-2019学年高二下学期期末考试化学试题黑龙江省齐齐哈尔市第八中学2018届高三上学期第一阶段测试化学试题【全国百强校】黑龙江省大庆市铁人中学2019届高三第一次模拟考试化学试题【全国百强校】黑龙江省大庆市铁人中学2018-2019学年高一上学期期末考试化学试题黑龙江省齐齐哈尔八中2018-2019学年高一上学期期末考试化学试题【全国百强校】黑龙江省实验中学2018-2019学年高一上学期期末考试化学试题【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高一下学期开学考试化学试题步步为赢 高二化学暑假作业:作业四 金属及其化合物内蒙古鄂尔多斯市第一中学2018-2019学年高二下学期期末考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高一上学期期中考试化学试题黑龙江大庆第十中学2019-2020学年高一上学期期末考试化学试题黑龙江省大庆市铁人中学2019-2020学年高一上学期期末考试化学试题浙江省宁波市北仑中学2019-2020学年高二6月月考化学试题(已下线)2015届山东省乐陵市第一中学高三10月初检测化学试卷2015届山东省桓台县二中高三上学期期末考试化学试卷2018届高三一轮复习化学:考点16-钠及其化合物的简单计算甘肃省兰州第一中学2018届高三上学期第二次月考(9月)化学试题安徽省六安市第一中学2018届高三上学期第二次月考化学试题湖北省宜昌市葛洲坝中学2018届高三9月月考化学试题河南省鹤壁市淇滨高级中学2017-2018学年高一上学期第三次月考化学试题(已下线)2017-2018学年第一学期期末复习备考之精准复习模拟题高一化学(必修1)(B卷)【全国市级联考】河南省驻马店市2016-2017学年高一下学期期末考试化学试题2018-2019学年 钠及其化合物 专项训练题安徽省六安市舒城中学2018-2019学年高一上学期第四次统考化学试题【全国百强校】山东省菏泽第一中学八一路校区2018-2019学年高一上学期12月月考化学试题江西省宜丰中学2018-2019学年高一下学期第一次月考化学试题云南省曲靖市会泽县第一中学2018-2019学年高一下学期第一次半月考试化学试题浙江省湖州市高中联盟2017-2018学年高一下学期期中联考化学试题(已下线)2019年7月27日《每日一题》 2020届一轮复习 周末培优浙江省湖州市高中联盟2018-2019学年高一下学期期中化学试题山东省济宁市2020届高三10月月考化学试卷山东省济宁市邹城第一中学2020届高三10月月考化学试题山东省莱阳市第一中学2020届高三10月月考化学试题江西省赣州市会昌中学2019-2020学年高一上学期第二次月考化学试题吉林省榆树市第一高级中学2019-2020学年高一上学期尖子生第二次考试化学试题(已下线)【南昌新东方】2019 新建二中 高一上第二次月考四川省自贡市田家炳中学2019-2020学年高一下学期开学考试化学试题(已下线)专题3.1 钠及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)第10讲 钠及其重要化合物(精练)——2021年高考化学一轮复习讲练测(已下线)第10讲 钠及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)期中模拟卷(一)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册第二章 海水中的重要元素 素养拓展区河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题(已下线)第2章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)安徽省芜湖市2021届高三第二次月考化学试题高一必修第一册(苏教2019版)专题3 B 素养拓展区 过综合 专题素养综合检测福建省福州市罗源第一中学2021届高三上学期10月月考化学试题天津市耀华中学2021届高三上学期第一次月考化学试题广东省韶关市田家炳中学2020-2021学年高一上学期期中考试化学试题吉林省油田高级中学2019-2020学年高一上学期期中考试化学试题吉林省白城市大安市第一中学校2020-2021学年高一上学期第三次月考化学试题河北省任丘市第一中学2020-2021学年高一上学期第二次阶段考试化学试题四川省南充高级中学2020-2021学年高一上学期第二次月考化学试题浙江省建德市严州中学新安江校区2020-2021学年高一上学期1月月考化学试题(已下线)【浙江新东方】在线化学36天津市静海区第一中学2020-2021学年高一上学期期末考试化学试题安徽省六安市舒城中学2020-2021学年高一下学期开学考试化学试题(已下线)小题10 离子推断 ——备战2021年高考化学经典小题考前必刷(全国通用)天津市新华中学2021-2022学年高三上学期第一次月考化学试题河北省邯郸市魏县旭日中学2021-2022学年高一上学期期中考试化学试题辽宁省北镇市满族高级中学2022-2023学年高三上学期第一次质量检测化学试题天津市第四十七中学2021-2022学年高一上学期第二次月考化学试题湖南省衡阳县第五中学2022-2023学年高一上学期期末考试化学试题天津市宝坻区第一中学2022-2023学年高一上学期线上期末训练化学试题四川省泸州市泸县2022-2023学年高一下学期开学考试化学试题天津市南开中学2023-2024学年高三上学期第一次月考化学试题天津市南开中学2023-2024学年高三上学期第一次月检测化学试题
名校
解题方法
5 . 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
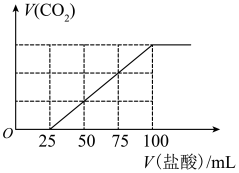

| A.原NaOH溶液的浓度为0.1mol·L-1 |
| B.通入CO2的体积为448mL(标准状况) |
| C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3 |
| D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=2∶1 |
您最近一年使用:0次
2020-10-28更新
|
1604次组卷
|
25卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高二下学期期末考试化学试题2016届黑龙江省大庆实验中学高三上学期开学考试化学试卷2016届黑龙江哈尔滨师大附中高三上学期期中考试化学试卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2017届黑龙江省双鸭山一中高三上学期第一次质检化学试卷安徽省淮北市第一中学2016-2017学年高二下学期期中考试化学试题【全国百强校】黑龙江省哈尔滨师范大学附属中学2018-2019学年高一下学期开学考试化学试题河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题黑龙江省七台河市勃利县高级中学2021届高三上学期期中考试化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高一下学期开学考试化学试题(已下线)2014届上海市虹口区高三上学期期末考试(一模)化学试卷(已下线)2015届贵州省贵阳市清华中学高三8月月考理综化学试卷2016届吉林省扶余市第一中学高三上学期第一次月考化学试卷2015-2016学年河南省洛阳市孟津一中高一上期末化学试卷2018届高三一轮复习化学:考点17-碳酸钠、碳酸氢钠的性质探究安徽省合肥市第六中学2017-2018学年高一上学期期中考试化学试题江西省上饶市上饶中学2019届高三上学期开学(实验、重点、特长班)检测化学试题吉林省通榆县第一中学2019届高三上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——化学计算中的常见方法和应用江西省九江市同文中学2019-2020学年度高一下学期期初考试化学试题人教版(2019)高一必修第一册 模块综合测评-B卷高一必修第一册(苏教2019版)专题3 第二单元 金属钠及钠的化合物 课时2 碳酸钠、碳酸氢钠河南省南阳市第一中学校2021届高三第三次月考化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记安徽省芜湖市第一中学2021-2022学年高一上学期第二次月末诊断测试化学试题
名校
解题方法
6 . 将标准状况下一定体积的CO2缓缓通入体积为VLNaOH溶液中,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(1)由于CO2通入量不同,所得到的白色固体的组成不同,推断并写出各种可能组成的化学式:(可以不填满,也可以添加序号)
①________ ;②________ ;③________ ;④________ ;⑤________ ;⑥________ 。
(2)按反应的先后顺序,写出各步反应的离子方程式:________ 。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1g白色沉淀。
①根据以上数据,能否推理计算出标准状况下CO2的体积?若能,用代数式表示CO2的体积V(CO2)=________ .若不能,理由是________ 。
②根据以上数据,能否推理计算出NaOH溶液的浓度?若能,用代数式表示NaOH溶液的浓度c(NaOH)=________ 。若不能,理由是________ 。
(1)由于CO2通入量不同,所得到的白色固体的组成不同,推断并写出各种可能组成的化学式:(可以不填满,也可以添加序号)
①
(2)按反应的先后顺序,写出各步反应的离子方程式:
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1g白色沉淀。
①根据以上数据,能否推理计算出标准状况下CO2的体积?若能,用代数式表示CO2的体积V(CO2)=
②根据以上数据,能否推理计算出NaOH溶液的浓度?若能,用代数式表示NaOH溶液的浓度c(NaOH)=
您最近一年使用:0次
名校
7 . 下列说法正确的是( )
①Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②Na2O和Na2O2投入到水中都能生成NaOH;
③质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的量相等;
④取ag Na2CO3和NaHCO3混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数;
⑤区别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液;
⑥NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑦NaHCO3粉末中混有Na2CO3,可配制成溶液通入过量的CO2,再低温结晶得到提纯。
①Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②Na2O和Na2O2投入到水中都能生成NaOH;
③质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的量相等;
④取ag Na2CO3和NaHCO3混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数;
⑤区别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液;
⑥NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑦NaHCO3粉末中混有Na2CO3,可配制成溶液通入过量的CO2,再低温结晶得到提纯。
| A.②③④ | B.②⑤⑦ | C.①②⑦ | D.③④⑥ |
您最近一年使用:0次
2019-11-07更新
|
2667次组卷
|
9卷引用:黑龙江省双鸭山市第一中学2019-2020学年高二下学期期末考试化学试题
黑龙江省双鸭山市第一中学2019-2020学年高二下学期期末考试化学试题天津市南开中学滨海生态城学校2019-2020高一上学期期中考试化学试题(已下线)2.1.2钠的几种化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)广东省汕头市潮南区2020-2021学年高一上学期第二次月考化学试题湖北省十堰市区县普通高中联合体2021-2022学年高一上学期期中联考化学试题山东省利津县高级中学2022-2023学年高一10月月考化学试题广东省梅州市五华县田家炳中学2022-2023学年高一上学期12月月考化学试题河南省南阳市2023-2024学年高一上学期10月月考化学试题山东省菏泽市郓城县第一中学2023-2024学年高一上学期10月月考化学试题
12-13高三上·吉林长春·阶段练习
名校
8 . 往100mLNaOH溶液中通入CO2,充分反应后,在减压和降温的条件下,小心将溶液蒸干得到白色固体M。通入CO2的体积V(CO2)(标准状况)与M的质量m(g)的关系如图所示。
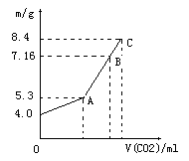
(1)A点时,白色固体的化学式__________ ,通入的CO2的体积为________ mL(标准状况下,下同)
(2)C点时,白色固体M的化学式为________ ,通入的CO2的体积为__________ mL;
(3)B点时M的组成为______ (用化学式表示)通入的CO2的体积为_____________ mL;
(4)原NaOH溶液的物质的量浓度为__________________________ 。

(1)A点时,白色固体的化学式
(2)C点时,白色固体M的化学式为
(3)B点时M的组成为
(4)原NaOH溶液的物质的量浓度为
您最近一年使用:0次
名校
9 . 将一定量的Na2CO3和NaHCO3的混合物加热,充分反应至固体质量不再减少,生成CO2气体的体积为2.24L,反应后的固体残渣与100mLHCl溶液恰好完全反应,又生成CO2气体4.48L(气体体积均在标准状况下测定)。试求:
(1)原混合物中Na2CO3和NaHCO3的物质的量各为多少_________ ?
(2)所用HCl溶液的物质的量浓度_________ 。
(1)原混合物中Na2CO3和NaHCO3的物质的量各为多少
(2)所用HCl溶液的物质的量浓度
您最近一年使用:0次
2018-09-09更新
|
329次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学(文)试题
名校
10 . 碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.93g,则原混合物中碳酸钠的质量为
| A.2.48g | B.2.58g | C.4.16g | D.4.41g |
您最近一年使用:0次
2018-01-27更新
|
2192次组卷
|
6卷引用:黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题



