1 . 金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题:
(1)经检测某酸性废水中所含离子及其浓度如表所示:
则c(Al3+)=___________ mol/L。
(2)已知Fe(NO3)3的高纯度结晶体是一种紫色潮解性固体,适用于制备磁性氧化铁纳米粉末。写出磁性氧化铁与足量稀硝酸反应的离子方程式:___________ 。
(3)用托盘天平(1g以下用游码)称量绿矾(FeSO4·7H2O)晶体配制450mL0.1mol/L溶液,以下实验操作会导致所配溶液浓度偏低的是___________ 。
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻线,未补加水
d.定容时,俯视刻度线
(4)8.34 g绿矾(FeSO4·7H2O)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:

温度为159 ℃时固体N的化学式为___________ ,取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种红棕色固体物质Q,同时有两种无色气体生成,请写出该反应的化学方程式___________ 。
(5)钠的化合物广泛应用于工业生产。
①NaH能与水剧烈反应,反应方程式为NaH+H2O=NaOH+H2↑,NaH与液氨也有类似的反应,请写出NaH与液氨反应的化学方程式___________ 。
②现有由两种含钠化合物组成的混合物,溶于水后,逐滴加入某浓度盐酸,所得CO2的粒子数目与所耗HCl的粒子数目关系如图,两种含钠化合物的化学式及物质的量之比为___________ 。

(1)经检测某酸性废水中所含离子及其浓度如表所示:
| 离子 | Fe3+ | Al3+ | SO | NO | H+ |
| 浓度(mol/L) | 2×10-2 | 1×10-1 | 2×10-2 | 1×10-1 |
(2)已知Fe(NO3)3的高纯度结晶体是一种紫色潮解性固体,适用于制备磁性氧化铁纳米粉末。写出磁性氧化铁与足量稀硝酸反应的离子方程式:
(3)用托盘天平(1g以下用游码)称量绿矾(FeSO4·7H2O)晶体配制450mL0.1mol/L溶液,以下实验操作会导致所配溶液浓度偏低的是
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻线,未补加水
d.定容时,俯视刻度线
(4)8.34 g绿矾(FeSO4·7H2O)晶体样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示:

温度为159 ℃时固体N的化学式为
(5)钠的化合物广泛应用于工业生产。
①NaH能与水剧烈反应,反应方程式为NaH+H2O=NaOH+H2↑,NaH与液氨也有类似的反应,请写出NaH与液氨反应的化学方程式
②现有由两种含钠化合物组成的混合物,溶于水后,逐滴加入某浓度盐酸,所得CO2的粒子数目与所耗HCl的粒子数目关系如图,两种含钠化合物的化学式及物质的量之比为

您最近一年使用:0次
名校
2 . NaHCO3溶液不仅在受热时能分解放出CO2,而且在室温时亦能分解。
请回答下列问题:
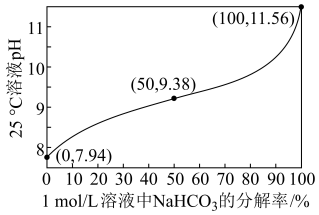
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。___________ 。
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性___________ (填“强”或“弱”)。
③0.5 mol·L-1 Na2CO3溶液的pH=___________ 。
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。___________ 。
②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为___________ 。
③实验结果偏低的原因是___________ 。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性
③0.5 mol·L-1 Na2CO3溶液的pH=
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。

②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为
③实验结果偏低的原因是
您最近一年使用:0次
2024-01-17更新
|
115次组卷
|
2卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
3 . 计算
(1)已知酸性条件下, 可将
可将 还原为
还原为 。将标准状况下
。将标准状况下 的
的 气体通入足量酸性
气体通入足量酸性 溶液中,
溶液中,
①写出该反应的离子方程式______ 。
②被还原的 的质量为
的质量为______ 。
(2)为了检验某含有 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将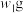 样品充分加热,当固体质量不再变化时,再次称量固体质量为
样品充分加热,当固体质量不再变化时,再次称量固体质量为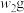 ,则该样品的纯度(质量分数)为
,则该样品的纯度(质量分数)为______ (用含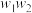 的代数式来表示)。
的代数式来表示)。
(3)有一块表面氧化成氧化钠的金属钠,总质量为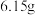 ,投入到足量水中,待充分反应后收集到氢气
,投入到足量水中,待充分反应后收集到氢气 (标准状况下),求未被氧化前金属钠质量是多少?写出计算过程
(标准状况下),求未被氧化前金属钠质量是多少?写出计算过程_____ 。
(1)已知酸性条件下,
 可将
可将 还原为
还原为 。将标准状况下
。将标准状况下 的
的 气体通入足量酸性
气体通入足量酸性 溶液中,
溶液中,①写出该反应的离子方程式
②被还原的
 的质量为
的质量为(2)为了检验某含有
 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将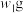 样品充分加热,当固体质量不再变化时,再次称量固体质量为
样品充分加热,当固体质量不再变化时,再次称量固体质量为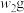 ,则该样品的纯度(质量分数)为
,则该样品的纯度(质量分数)为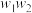 的代数式来表示)。
的代数式来表示)。(3)有一块表面氧化成氧化钠的金属钠,总质量为
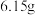 ,投入到足量水中,待充分反应后收集到氢气
,投入到足量水中,待充分反应后收集到氢气 (标准状况下),求未被氧化前金属钠质量是多少?写出计算过程
(标准状况下),求未被氧化前金属钠质量是多少?写出计算过程
您最近一年使用:0次
名校
解题方法
4 . 碳酸钠是一种重要的化工原料,在生产、生活和实验研究中均有广泛应用。下面是与碳酸钠溶液相关问题的探讨,请按要求回答问题。
(1)实验室需配制240 mL 1.5 mol/LNa2CO3溶液,请回答下列问题:
①实验中除了用到托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有_______ 。
②通过计算可知,该实验需要用托盘天平称量_______ g Na2CO3·10H2O。
③经测定实际配得溶液的浓度为1.4 mol/L,原因不可能_______ (填序号)。
a.转移溶液前容量瓶内有少量蒸馏水 b.定容摇匀后,发现液面下降,继续加水至刻度线
c.转移溶液后未洗涤烧杯 d.定容时俯视刻度线
(2)FeCO3与砂糖混用可以作补血剂,工业上用Na2CO3溶液和FeSO4溶液发生复分解反应制备。(已知溶液pH大于8.8时,Fe2+转化为Fe(OH)2沉淀,实验中所用Na2CO3溶液的pH=10)。
①在烧杯中混合上述溶液制备 FeCO3沉淀时的具体操作为_______ 。
②将FeSO4溶液缓慢加入到盛有NaHCO3溶液的烧杯中也能得到FeCO3沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为_______ 。
(3)某同学在常温下,向100 mL NaOH溶液中通入一定量的CO2气体制备Na2CO3溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3 mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。请你帮他仔细分析实验结果。
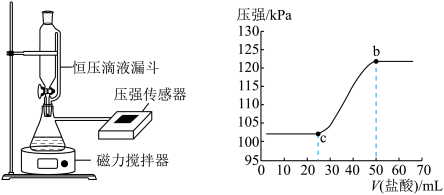
①该同学所得溶液的溶质成分为_______ 。
②该同学使用的NaOH溶液的物质的量浓度不低于_______ mol/L
(1)实验室需配制240 mL 1.5 mol/LNa2CO3溶液,请回答下列问题:
①实验中除了用到托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有
②通过计算可知,该实验需要用托盘天平称量
③经测定实际配得溶液的浓度为1.4 mol/L,原因不可能
a.转移溶液前容量瓶内有少量蒸馏水 b.定容摇匀后,发现液面下降,继续加水至刻度线
c.转移溶液后未洗涤烧杯 d.定容时俯视刻度线
(2)FeCO3与砂糖混用可以作补血剂,工业上用Na2CO3溶液和FeSO4溶液发生复分解反应制备。(已知溶液pH大于8.8时,Fe2+转化为Fe(OH)2沉淀,实验中所用Na2CO3溶液的pH=10)。
①在烧杯中混合上述溶液制备 FeCO3沉淀时的具体操作为
②将FeSO4溶液缓慢加入到盛有NaHCO3溶液的烧杯中也能得到FeCO3沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为
(3)某同学在常温下,向100 mL NaOH溶液中通入一定量的CO2气体制备Na2CO3溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3 mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示。请你帮他仔细分析实验结果。

①该同学所得溶液的溶质成分为
②该同学使用的NaOH溶液的物质的量浓度不低于
您最近一年使用:0次
名校
5 . 将一定物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50mL溶液,然后滴加盐酸与其反应,结果如图,下列说法正确的是
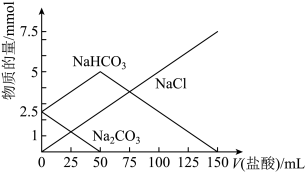

| A.标注NaCl的直线也能代表产生的CO2的物质的量的变化情况 |
| B.原混合物中Na2CO3与NaHCO3的物质的量之比为1:1 |
C.盐酸的浓度是0.05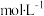 |
| D.加入的盐酸为150mL时,放出CO2气体2.24L(标准状况下) |
您最近一年使用:0次
2022-10-01更新
|
177次组卷
|
2卷引用:黑龙江省佳木斯市汤原县高级中学2021-2022学年高一上学期期末考试化学试题
名校
6 . 完成下列问题。
(1)现有8种物质:① ②
② ③浓硫酸④铝⑤
③浓硫酸④铝⑤ 胶体⑥蔗糖溶液⑦
胶体⑥蔗糖溶液⑦ ⑧
⑧ 。上述物质中属于电解质的有
。上述物质中属于电解质的有_______ (选填序号);写出②的溶液与⑤反应的离子方程式_______
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,研究人员提出,在碱性条件下可以用铝粉处理
的浓度,研究人员提出,在碱性条件下可以用铝粉处理 ,发生反应的化学方程式为:
,发生反应的化学方程式为: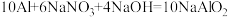
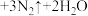 ,该反应中,还原剂为
,该反应中,还原剂为_______ ,若反应过程中转移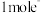 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为_______  。
。
(3)在含有一定量 和
和 溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生
溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生 的物质的量与滴入盐酸的量的关系如图,回答下列问题:
的物质的量与滴入盐酸的量的关系如图,回答下列问题:
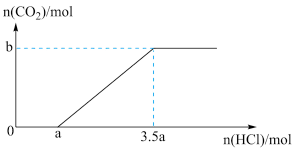
①0→a点发生反应的离子方程式为_______
② 与
与 物质的量之比为
物质的量之比为_______
③b=_______ (用含a的代数式表示)
(1)现有8种物质:①
 ②
② ③浓硫酸④铝⑤
③浓硫酸④铝⑤ 胶体⑥蔗糖溶液⑦
胶体⑥蔗糖溶液⑦ ⑧
⑧ 。上述物质中属于电解质的有
。上述物质中属于电解质的有(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,研究人员提出,在碱性条件下可以用铝粉处理
的浓度,研究人员提出,在碱性条件下可以用铝粉处理 ,发生反应的化学方程式为:
,发生反应的化学方程式为: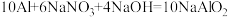
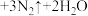 ,该反应中,还原剂为
,该反应中,还原剂为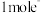 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为 。
。(3)在含有一定量
 和
和 溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生
溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生 的物质的量与滴入盐酸的量的关系如图,回答下列问题:
的物质的量与滴入盐酸的量的关系如图,回答下列问题:
①0→a点发生反应的离子方程式为
②
 与
与 物质的量之比为
物质的量之比为③b=
您最近一年使用:0次
名校
解题方法
7 . 将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水配成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积 标准状况
标准状况 关系如图所示。
关系如图所示。
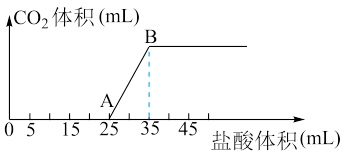
请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有____ (填化学式)。
(2)AB段发生的离子反应方程式____ 。
(3)当到达B点时,产生CO2的体积为____ mL(标准状况)。
(4)计算原混合物中Na2CO3的质量分数____ (结果保留3位有效数字)
 标准状况
标准状况 关系如图所示。
关系如图所示。
请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有
(2)AB段发生的离子反应方程式
(3)当到达B点时,产生CO2的体积为
(4)计算原混合物中Na2CO3的质量分数
您最近一年使用:0次
名校
解题方法
8 . 纯碱和小苏打在工业、生活中有着广泛的应用。现有 和
和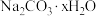 的混合物,为了测定x的值,某同学采用如图所示的装置进行实验(无水
的混合物,为了测定x的值,某同学采用如图所示的装置进行实验(无水 、碱石灰均足量)。
、碱石灰均足量)。
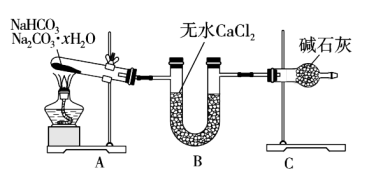
已知:碱石灰是氢氧化钠和氧化钙的固体混合物。请回答下列问题:
(1)C装置中装有碱石灰的仪器名称是___________ 。
(2)加热A装置,混合物分别发生反应的化学方程式为___________ 、___________ 。
(3)无水氯化钙的作用是___________ 。
(4)若在装置A的试管中装入 和
和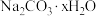 的混合物
的混合物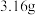 ,用酒精灯加热至反应完全,此时B装置增重
,用酒精灯加热至反应完全,此时B装置增重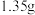 ,C装置增重
,C装置增重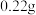 ,则ⅹ的值为
,则ⅹ的值为___________ 。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进?___________ 。
 和
和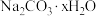 的混合物,为了测定x的值,某同学采用如图所示的装置进行实验(无水
的混合物,为了测定x的值,某同学采用如图所示的装置进行实验(无水 、碱石灰均足量)。
、碱石灰均足量)。
已知:碱石灰是氢氧化钠和氧化钙的固体混合物。请回答下列问题:
(1)C装置中装有碱石灰的仪器名称是
(2)加热A装置,混合物分别发生反应的化学方程式为
(3)无水氯化钙的作用是
(4)若在装置A的试管中装入
 和
和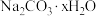 的混合物
的混合物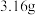 ,用酒精灯加热至反应完全,此时B装置增重
,用酒精灯加热至反应完全,此时B装置增重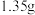 ,C装置增重
,C装置增重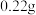 ,则ⅹ的值为
,则ⅹ的值为(5)该装置还不是很完善,可能使测定结果偏小,应如何改进?
您最近一年使用:0次
2021-12-31更新
|
264次组卷
|
2卷引用:黑龙江省齐齐哈尔市2021-2022学年高一上学期期末考试化学试题
名校
解题方法
9 . 纯碱是重要的生活用碱和化工原料,用途广泛。请同学们按要求回答问题。
Ⅰ.纯碱生产:我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下。
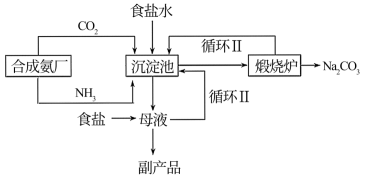
(1)请写出煅烧炉中发生反应的化学方程式:___________ 。
(2)侯氏制碱的创新之处:根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在5℃~10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥,大大提高了原料利用率、降低了生产成本,为世界制碱业做出了巨大贡献。依据上述信息可知,副产品的成分为___________ ,循环Ⅰ中物质的主要成分是___________ 。(本小题涉及到的物质均写化学式)
Ⅱ.产品纯度的测定:上述生产中获得的纯碱产品中含有少量NaCl杂质,为测定该样品中纯碱的质量分数,可用如图所示的装置进行实验。
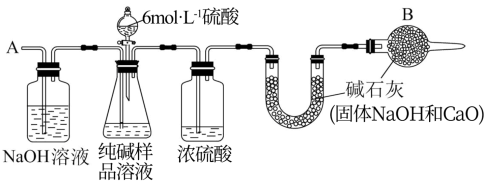
主要实验步骤如下:
①按如图所示装置来组装仪器,并检查装置的气密性;
②将a g纯碱样品放入锥形瓶中,加入适量蒸馏水溶解,得到纯碱样品溶液;
③称量盛有碱石灰的U形管的质量为b g;
④通过分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体为止;
⑤从导管A处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的U形管的质量为c g;
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g.
请回答下列问题:
(3)装置中干燥管B的作用是___________ 。
(4)从A处通入的空气如果不经过NaOH溶液,测量结果将___________ (填“偏高”、“偏低”或“不变”)。
(5)步骤⑤的目的是___________ 。
(6)步骤⑦的目的是___________ 。
(7)该样品中纯碱的质量分数的计算式为___________ 。
(8)如果所得产品中除含有少量NaCl杂质外还含有少量NaHCO3杂质,下列实验方案中能测定出产品中纯碱的质量分数的是___________ 。
A.取a g产品充分加热,质量减少b g。
B.取a g产品与足量Ba(OH)2溶液反应,过滤、洗涤、干燥,得到b g固体。
C.取a g产品与足量BaCl2溶液反应,过滤、洗涤、干燥,得到b g固体。
Ⅰ.纯碱生产:我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下。

(1)请写出煅烧炉中发生反应的化学方程式:
(2)侯氏制碱的创新之处:根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在5℃~10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥,大大提高了原料利用率、降低了生产成本,为世界制碱业做出了巨大贡献。依据上述信息可知,副产品的成分为
Ⅱ.产品纯度的测定:上述生产中获得的纯碱产品中含有少量NaCl杂质,为测定该样品中纯碱的质量分数,可用如图所示的装置进行实验。

主要实验步骤如下:
①按如图所示装置来组装仪器,并检查装置的气密性;
②将a g纯碱样品放入锥形瓶中,加入适量蒸馏水溶解,得到纯碱样品溶液;
③称量盛有碱石灰的U形管的质量为b g;
④通过分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体为止;
⑤从导管A处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的U形管的质量为c g;
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g.
请回答下列问题:
(3)装置中干燥管B的作用是
(4)从A处通入的空气如果不经过NaOH溶液,测量结果将
(5)步骤⑤的目的是
(6)步骤⑦的目的是
(7)该样品中纯碱的质量分数的计算式为
(8)如果所得产品中除含有少量NaCl杂质外还含有少量NaHCO3杂质,下列实验方案中能测定出产品中纯碱的质量分数的是
A.取a g产品充分加热,质量减少b g。
B.取a g产品与足量Ba(OH)2溶液反应,过滤、洗涤、干燥,得到b g固体。
C.取a g产品与足量BaCl2溶液反应,过滤、洗涤、干燥,得到b g固体。
您最近一年使用:0次
名校
解题方法
10 . 向100 mL NaOH溶液中通入一定量的CO2气体,经充分反应后,再向所获得的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断不正确的是
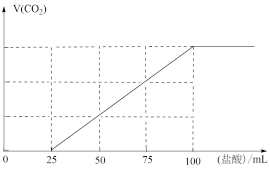

| A.原NaOH溶液的物质的量浓度为0.1 mol·L-1 |
| B.通入CO2的体积为224 mL |
C.V(盐酸)=0~25 mL的范围内发生的离子反应为:CO +H+=HCO +H+=HCO |
| D.所得溶液的溶质成分为Na2CO3和NaHCO3且物质的量之比为1∶2 |
您最近一年使用:0次



