名校
1 . 将一定物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50mL溶液,然后滴加盐酸与其反应,结果如图,下列说法正确的是
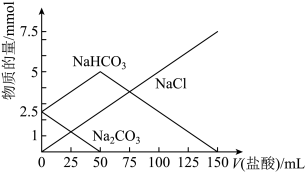

| A.标注NaCl的直线也能代表产生的CO2的物质的量的变化情况 |
| B.原混合物中Na2CO3与NaHCO3的物质的量之比为1:1 |
C.盐酸的浓度是0.05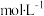 |
| D.加入的盐酸为150mL时,放出CO2气体2.24L(标准状况下) |
您最近一年使用:0次
2022-10-01更新
|
177次组卷
|
2卷引用:黑龙江省鸡西实验学校2023-2024学年高三上学期开学化学试题
2 . 向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示:

(1)原NaOH溶液的浓度为_______
(2)通入CO2在标准状况下的体积为_______ mL
(3)所得溶液的溶质成分及物质的量之比为_______
(4)在配制盐酸溶液时,将标况下VLHCl气体溶于100mL水中,所得溶液密度为d g·cm-3,则此溶液的物质的量浓度为_______ mol·L-1

(1)原NaOH溶液的浓度为
(2)通入CO2在标准状况下的体积为
(3)所得溶液的溶质成分及物质的量之比为
(4)在配制盐酸溶液时,将标况下VLHCl气体溶于100mL水中,所得溶液密度为d g·cm-3,则此溶液的物质的量浓度为
您最近一年使用:0次
2021-10-26更新
|
254次组卷
|
2卷引用:黑龙江省虎林市高级中学2022-2023学年高三上学期第一次月考化学试题
名校
解题方法
3 . 有关NaHCO3和Na2CO3的性质,以下叙述错误的是
| A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积大 |
| B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3多 |
| C.将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀 |
| D.等物质的量浓度的两种溶液,Na2CO3溶液的碱性弱于NaHCO3溶液 |
您最近一年使用:0次
名校
4 . 为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:
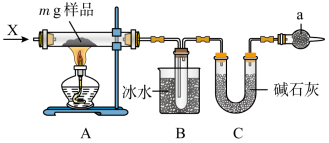
下列说法错误的是

下列说法错误的是
| A.仪器a中试剂的作用是防止外界的水蒸气与二氧化碳进入装置C中 |
| B.装置B中冰水的作用是冷凝反应生成的水 |
| C.样品分解不完全可能使碳酸钠的质量分数偏高 |
| D.产生CO2气体的速率太快,没有被碱石灰完全吸收可能使碳酸钠的质量分数偏低 |
您最近一年使用:0次
2020-08-24更新
|
281次组卷
|
4卷引用:黑龙江省鸡西市第一中学2020-2021学年高一上学期第一次月考化学试题
名校
5 . Ⅰ.实验室需要配制0.1 mol·L-1NaOH溶液500mL。
(1)根据计算用托盘天平称取的质量为__________ g。在下图所示仪器中,配制上述溶液肯定不需要的是_________ (填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 _____________ 。

(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________ 。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)下面操作造成所配NaOH溶液浓度偏高的是(_____ )
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
II.向浓度相等、体积均为100 mL 的 A、B 两份NaOH 溶液中,分别通入一定量的 CO2 后,再向所得溶液中滴加0.1 mol/L 盐酸 , 产生 CO2 的体积(标准状况)与所加盐酸的体积关系如图所示。
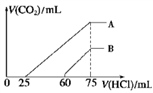
(4)①A 曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2 的最大体积是_________ mL(标准状况)。
②B 曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________ 。
III.某学生用 Na2CO3和 NaHCO3 组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)
(5)原混合物样品中 n(Na2CO3)∶n(NaHCO3)=____________ , 盐酸的物质的量浓度为________ mol/L ,实验③反应后,至少需继续加入_____ mL的该盐酸溶液才能把混合物全部反应。
(1)根据计算用托盘天平称取的质量为

(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)下面操作造成所配NaOH溶液浓度偏高的是(
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
II.向浓度相等、体积均为100 mL 的 A、B 两份NaOH 溶液中,分别通入一定量的 CO2 后,再向所得溶液中滴加0.1 mol/L 盐酸 , 产生 CO2 的体积(标准状况)与所加盐酸的体积关系如图所示。

(4)①A 曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2 的最大体积是
②B 曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为
III.某学生用 Na2CO3和 NaHCO3 组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)
| 实验序号 | ① | ② | ③ |
| 盐酸体积/mL | 50 | 50 | 50 |
| 固体质量/g | 4.11 | 8.22 | 16.44 |
| 生成气体体积/L(标况) | 1.008 | 2.016 | 2.016 |
(5)原混合物样品中 n(Na2CO3)∶n(NaHCO3)=
您最近一年使用:0次
2017-03-11更新
|
539次组卷
|
2卷引用:2016-2017学年黑龙江省虎林市高级中学高一下学期第二次月考化学试卷



