1 . 向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示:

(1)原NaOH溶液的浓度为_______
(2)通入CO2在标准状况下的体积为_______ mL
(3)所得溶液的溶质成分及物质的量之比为_______
(4)在配制盐酸溶液时,将标况下VLHCl气体溶于100mL水中,所得溶液密度为d g·cm-3,则此溶液的物质的量浓度为_______ mol·L-1

(1)原NaOH溶液的浓度为
(2)通入CO2在标准状况下的体积为
(3)所得溶液的溶质成分及物质的量之比为
(4)在配制盐酸溶液时,将标况下VLHCl气体溶于100mL水中,所得溶液密度为d g·cm-3,则此溶液的物质的量浓度为
您最近一年使用:0次
2021-10-26更新
|
254次组卷
|
2卷引用:黑龙江省虎林市高级中学2022-2023学年高三上学期第一次月考化学试题
名校
解题方法
2 . 有关NaHCO3和Na2CO3的性质,以下叙述错误的是
| A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积大 |
| B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3多 |
| C.将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀 |
| D.等物质的量浓度的两种溶液,Na2CO3溶液的碱性弱于NaHCO3溶液 |
您最近一年使用:0次
名校
3 . 如图中,A为一种常见的金属单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。
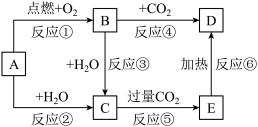
(1)写出下列物质的化学式:B_______ ;E_______ 。
(2)写出B→C反应的化学方程式:_______ ;E→D的化学方程式:_______ 。
(3)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量为_______ 。

(1)写出下列物质的化学式:B
(2)写出B→C反应的化学方程式:
(3)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量为
您最近一年使用:0次
2021-10-09更新
|
225次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2021-2022学年高一上学期期中考试化学试题
名校
4 . 现有含 、
、 和
和 的混合物,某同学设计如图所示的实验装置,通过测量反应产生的
的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 和
和 的质量,来确定该混合物中各组分的质量分数。
的质量,来确定该混合物中各组分的质量分数。
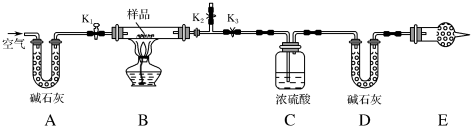
(1)实验步骤:
①按图(夹持装置已省略)组装好实验装置后,首先进行的操作是___________ 。
②称取样品,并将其放入硬质玻璃管中;称量盛装浓硫酸的洗气瓶C的质量和盛装碱石灰的U形管D的质量。
③打开 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟,其目的是
,缓缓鼓入空气数分钟,其目的是___________ 。
④关闭 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为___________ 、___________ 。
⑤打开 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对测定结果的影响是___________ 。
②E处干燥管中盛放的药品是___________ ,其作用是___________ ,如果实验中没有该装置,则会导致测量结果中 的质量分数
的质量分数___________ (填“偏大”“偏小”或“无影响”)。
 、
、 和
和 的混合物,某同学设计如图所示的实验装置,通过测量反应产生的
的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 和
和 的质量,来确定该混合物中各组分的质量分数。
的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持装置已省略)组装好实验装置后,首先进行的操作是
②称取样品,并将其放入硬质玻璃管中;称量盛装浓硫酸的洗气瓶C的质量和盛装碱石灰的U形管D的质量。
③打开
 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟,其目的是
,缓缓鼓入空气数分钟,其目的是④关闭
 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为⑤打开
 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对测定结果的影响是
②E处干燥管中盛放的药品是
 的质量分数
的质量分数
您最近一年使用:0次
2021-09-29更新
|
306次组卷
|
3卷引用:黑龙江省齐齐哈尔市齐齐哈尔中学2020-2021学年高一上学期期中考试化学试卷
名校
解题方法
5 . 取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是
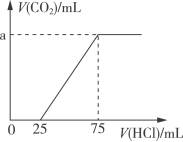

| A.原溶液中NaOH的物质的量为0.75mol |
| B.通入CO2后所得的溶液溶质成分为NaOH和Na2CO3 |
| C.通入CO2后所得的溶液中含有2.5×10-3molNaHCO3 |
| D.原溶液通入CO2标准状况下为224mL |
您最近一年使用:0次
2021-09-16更新
|
1337次组卷
|
5卷引用:黑龙江宾县第一中学2020-2021学年高一上学期第二次月考化学试题
黑龙江宾县第一中学2020-2021学年高一上学期第二次月考化学试题吉林省通榆县第一中学2021届高三上学期第二次月考化学试题(已下线)微项目 探秘膨松剂-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)广东省普宁市华侨中学2021—2022学年高一上学期第三次月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高一10月第二次考试化学试题
名校
解题方法
6 . 在200g8%的NaOH溶液中通入一定量的CO2后,再向溶液中逐滴滴加稀盐酸至150g时开始产生气体,继续滴加稀盐酸到200g时,气体质量最大(假设CO2全部逸出)。溶液中产生CO2的质量与加入盐酸的质量如右图所示。下列说法正确的是(设盐酸的密度为1g/mL)
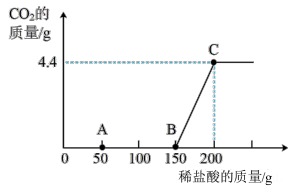

| A.B点时所得溶液的溶质为NaHCO3 |
| B.AB段发生的反应只有Na2CO3+HCl=NaHCO3+NaCl |
| C.最初通入的CO2的质量为8.8g |
| D.加入盐酸的物质的量浓度为2mol/L |
您最近一年使用:0次
2021-08-06更新
|
514次组卷
|
5卷引用:黑龙江省哈尔滨市宾县第二中学2021-2022学年高三上学期第一次月考化学试题
名校
7 . I、某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题,可供选择的试剂有:A.大理石 B.盐酸 C.氢氧化钠溶液 D.澄清石灰水
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液 Na2CO3溶液
Na2CO3溶液
乙:NaOH溶液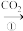 NaHCO3溶液
NaHCO3溶液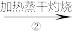 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液
丙:NaOH溶液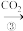 NaHCO3溶液
NaHCO3溶液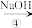 Na2CO3溶液
Na2CO3溶液
请回答下列问题:
(1)___________ 方案最优,其实验的关键是:_________ 。
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学___________ (填“能”或“不能”)达到实验目的;若能,请说明计算所需的数据;若不能,请简要说明理由:___________ 。
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需___________ g的NaOH固体;实验中用到的玻璃仪器除了烧杯、玻璃棒、胶头滴管、量筒、试剂瓶,还需要___________ 。
(4)下列实验步骤,正确的操作顺序是:___________ 。
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将___________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中用滤纸称量固体,所配溶液的浓度将___________ ;如果上述C操作中目光俯视,所配溶液的浓度将___________ 。
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液
 Na2CO3溶液
Na2CO3溶液乙:NaOH溶液
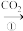 NaHCO3溶液
NaHCO3溶液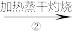 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液丙:NaOH溶液
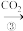 NaHCO3溶液
NaHCO3溶液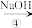 Na2CO3溶液
Na2CO3溶液请回答下列问题:
(1)
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需
(4)下列实验步骤,正确的操作顺序是:
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将
您最近一年使用:0次
名校
解题方法
8 . 向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是
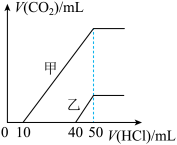

| A.乙溶液中含有的溶质是Na2CO3、NaHCO3 |
| B.当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为OH-+H+ =H2O |
| C.原NaOH溶液的物质的量浓度为0.5mol·L-1 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
您最近一年使用:0次
2021-05-28更新
|
2596次组卷
|
25卷引用:黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题
黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题(已下线)2014届安徽省“江淮十校”协作体高三上学期第一次联考化学试卷2016届山东省威海市乳山市高三上学期期中测试化学试卷2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷2017届河北省涞水县波峰中学高三8月月考化学试卷河南省豫南豫北名校2018届高三精英联赛化学试题1陕西省陕师大附中2018届高三第五次月考化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2【全国百强校】天津市第一中学2019届高三上学期第一次月考化学试题【全国百强校】甘肃省天水市第一中学2019届高三上学期一轮复习第二次质量检测化学试题【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高一上学期第二次月考化学试题(已下线)2019年1月14日 《每日一题》高考二轮复习-钠及其化合物上海市十二校2015届高三12月联考化学试题天津一中2020届高三第二次月考化学试题福建省福州市第三中学2020-2021学年高三上学期第二次质量检测化学试题河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)广东省广州市三校2021-202学年高一上学期期末联考化学试题(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省南充高级中学2021-2022学年高一下学期开学考试化学试题陕西师范大学附属中学2023-2024学年高一上学期期中考试化学试题湖北省荆州市荆州中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
9 . 现加热5g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为
| A.3.38g | B.4.58g | C.4.16g | D.4.41g |
您最近一年使用:0次
2021-03-14更新
|
270次组卷
|
9卷引用:黑龙江省佳木斯市建三江管理局第二高级中学2021-2022学年高一上学期期中考试化学试题
黑龙江省佳木斯市建三江管理局第二高级中学2021-2022学年高一上学期期中考试化学试题江苏省南京市第十二中学2020-2021学年高一上学期期中考试化学试题(已下线)3.2.2 碳酸钠 碳酸氢钠(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)吉林省长春北师大附属学校2021-2022学年高一上学期期中考试化学试题豫中名校2022-2023学年高一上学期期中考试化学试题重庆市南开中学校2022-2023学年高一上学期12月月考化学试题宁夏银川市唐徕中学2023-2024学年高三上学期9月月考化学试题广东省茂名市信宜市2023-2024学年高一上学期11月期中考试化学试题江苏省徐州华顿学校2023-2024学年 高一上学期 期中考试化学试卷
名校
解题方法
10 . 浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。下列判断不正确的是
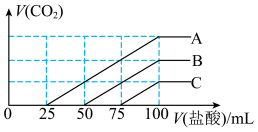

| A.原NaOH溶液的浓度为0.2 mol·L-1 |
| B.B烧杯中通入的CO2体积为448 mL(标准状况) |
| C.通入CO2后,A烧杯中的溶质为Na2CO3和NaHCO3 |
| D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=2∶1 |
您最近一年使用:0次
2021-03-01更新
|
541次组卷
|
5卷引用:黑龙江省齐齐哈尔市地区普高联谊校2023-2024学年高三上学期9月月考化学试题
黑龙江省齐齐哈尔市地区普高联谊校2023-2024学年高三上学期9月月考化学试题(已下线)专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练(已下线)专题06 钠及其化合物(热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练河南省名校联盟2021-2022学年高三10月联考化学试题辽宁省渤海大学附属高级中学2021-2022学年高一上学期第二次月考化学试题



