1 . 关于下列实验操作、现象和相应结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用CCl4萃取碘水后,先从下口放出下层溶液,再向另一个烧杯中从下口放出上层液体 | 下层溶液为紫色,上层为无色 | CCl4的密度比水大且碘在CCl4中溶解度比在水中的大 |
| B | 向过氧化钠样品中滴加过量的盐酸,将生成的气体通入CaCl2溶液 | 无白色沉淀产生 | 样品未变质 |
| C | 鉴别碳酸钠、碳酸氢钠溶液,向装有两溶液的两支试管中滴加氢氧化钡溶液 | 一支试管无明显现象,一支试管中产生白色沉淀 | 产生白色沉淀的溶液是碳酸钠 |
| D | 向NaBr溶液中加入少量苯,通入适量Cl2后,充分振荡、静置 | 有机层变为橙红色 | Cl2的氧化性强于Br2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 某兴趣小组设计如图所示实验装置,验证 与
与 能否发生反应。已知
能否发生反应。已知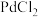 能被CO还原得到黑色的金属Pd。请回答下列问题:
能被CO还原得到黑色的金属Pd。请回答下列问题:

(1)猜想: 与
与 能发生反应。理论依据是
能发生反应。理论依据是___________ 。
(2)装置B中的试剂是___________ ,作用是___________ 。
(3)将样品装入硬质玻璃管中,再按如下顺序进行实验操作。
①打开 和
和 ,通入
,通入 待E中出现
待E中出现___________ 时,再点燃酒精灯,此操作的目的是___________ ;②熄灭酒精灯;③冷却到室温;④关闭 和
和 。
。
(4)加热D装置中硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和白色固体产生。
③F中试管内壁有黑色沉淀产生。
产生上述现象②中黑色固体的原因是___________ 。
(5)探究硬质玻璃管中固体产物中钠元素的存在形式
假设一:白色固体是 ;假设二:白色固体是
;假设二:白色固体是 ;假设三:白色固体是
;假设三:白色固体是 和
和 的混合物。请完成下列实验设计,验证上述假设;
的混合物。请完成下列实验设计,验证上述假设;
步骤1:将硬质玻璃管中的固体产物溶于水后,过滤;
步骤2:往步骤1所得滤液中加入足量的___________ 溶液产生白色沉淀,过滤;
步骤3:往步骤2所得滤液中滴加几滴酚酞试液,滤液不变红色。
结论:假设一成立。
 与
与 能否发生反应。已知
能否发生反应。已知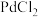 能被CO还原得到黑色的金属Pd。请回答下列问题:
能被CO还原得到黑色的金属Pd。请回答下列问题:
(1)猜想:
 与
与 能发生反应。理论依据是
能发生反应。理论依据是(2)装置B中的试剂是
(3)将样品装入硬质玻璃管中,再按如下顺序进行实验操作。
①打开
 和
和 ,通入
,通入 待E中出现
待E中出现 和
和 。
。(4)加热D装置中硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和白色固体产生。
③F中试管内壁有黑色沉淀产生。
产生上述现象②中黑色固体的原因是
(5)探究硬质玻璃管中固体产物中钠元素的存在形式
假设一:白色固体是
 ;假设二:白色固体是
;假设二:白色固体是 ;假设三:白色固体是
;假设三:白色固体是 和
和 的混合物。请完成下列实验设计,验证上述假设;
的混合物。请完成下列实验设计,验证上述假设;步骤1:将硬质玻璃管中的固体产物溶于水后,过滤;
步骤2:往步骤1所得滤液中加入足量的
步骤3:往步骤2所得滤液中滴加几滴酚酞试液,滤液不变红色。
结论:假设一成立。
您最近一年使用:0次
2023-05-15更新
|
572次组卷
|
2卷引用:广东省广州中学2022-2023学年高一上学期期中考试化学试题
名校
3 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
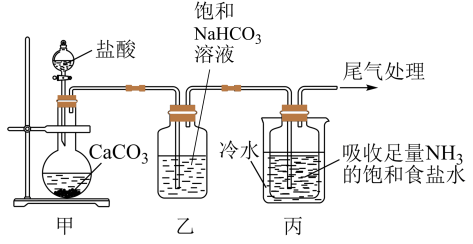
(1)装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为____ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、_______ ,最后一步发生反应的化学方程式为_______ 。
II.测定所得产品的组成和纯度
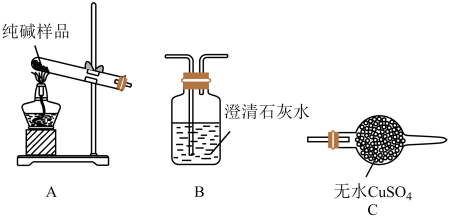
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为_______ 。请另设计一个实验方案,测定纯碱样品的纯度(样品中只含有NaHCO3杂质)_______ 。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙的作用是
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
2022-08-21更新
|
474次组卷
|
2卷引用:陕西省西安市长安区第一中学2021-2022学年高一上学期期末考试化学试题
名校
4 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
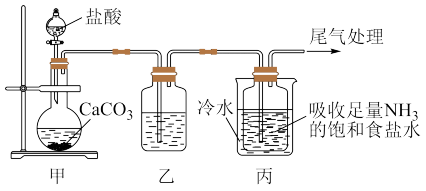
(1)装置乙中盛放的试剂为_______ ,它的作用是_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中总反应的化学方程式为_______ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______ 、洗涤固体、_______ ,最后一步发生反应的化学方程式为_______ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙中盛放的试剂为
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中总反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
解题方法
5 . 碳酸钠是一种重要化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,其步骤如下:①将氯化钠固体溶于水,并加入NH4HCO3粉末;②在30 ~ 50 °C条件下加热;③过滤,得到晶体A;④将晶体A在300°C加热,最后得到碳酸钠。已知:在铵盐的浓溶液中碳酸氢钠的溶解度较小。回答下列问题:
(1)步骤②中的加热方式是_______ 。
(2)写出生成晶体A的化学方程式_______ 。
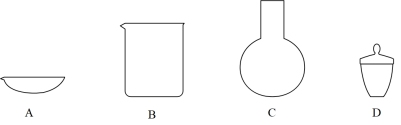
(3)步骤④中“300° C加热”所选用的仪器是_______ (填标号)。
(4)下列有关碳酸钠和碳酸氢钠的叙述正确的是_______。
(5)世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法,其流程为:流程I是向NaCl(s)中加浓H2SO4并加热到600 -700℃,获得Na2SO4(s) ;流程II是Na2SO4(s)中加木炭、石灰石并加热到1000℃,获得Na2CO3(s)。其中流程II的反应分步进行:①Na2SO4+4C Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为
Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为_______ ;Na2S在流程II中所起的作用有_______ (填编号)。
a.催化剂 b.中间产物 c.氧化产物 d.还原产物
(6)检验产品中是否有杂质碳酸氢钠:称取w1g样品于坩埚中,充分加热后,得到w2g残留固体。若含碳酸氢钠杂质,则w1_______ w2(选填“>”、“<”或“=”)。
(1)步骤②中的加热方式是
(2)写出生成晶体A的化学方程式
(3)步骤④中“300° C加热”所选用的仪器是

(4)下列有关碳酸钠和碳酸氢钠的叙述正确的是_______。
| A.常温下,向相同浓度的碳酸钠和碳酸氢钠溶液中各滴入2滴酚酞试液,前者红色更深 |
| B.碳酸钠的热稳定性弱于碳酸氢钠 |
| C.常温下,相同浓度的碳酸钠和碳酸氢钠分别与足量的等浓度盐酸反应,前者反应更剧烈 |
| D.在两支试管里分别加入碳酸钠固体和碳酸氢钠固体各1g,再各滴入几滴水,前者试管底部变热,后者变冷 |
 Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为
Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为a.催化剂 b.中间产物 c.氧化产物 d.还原产物
(6)检验产品中是否有杂质碳酸氢钠:称取w1g样品于坩埚中,充分加热后,得到w2g残留固体。若含碳酸氢钠杂质,则w1
您最近一年使用:0次
名校
6 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为_______ ;装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为_______ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、_______ ,最后一步发生反应的化学方程式为_______ 。
Ⅱ.测定所得产品的组成和纯度
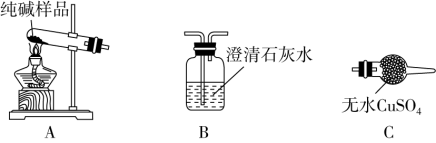
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:
(5)测定该纯碱样品的纯度:称取m1 g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2 g。则该纯碱样品的纯度为_______ 。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:

| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次



