名校
解题方法
1 . 判断正误,错误的说明原因_______ 。
| 说法 | 判断 | 错误的说明原因 |
| Na2CO3溶于水伴随放热现象,NaHCO3溶于水伴随吸热现象 | _______ | _______ |
| CaO与水反应生成碱,Na2O与水反应也生成碱 | _______ | _______ |
| Na与Cl之间形成离子键,Al与Cl之间也形成离子键 | _______ | _______ |
| 常温常压下,46gNO2和N2O4混合气体中含有的原子总数为3NA | _______ | _______ |
| 7.1gCl2与H2O反应转移电子数为0.1NA | _______ | _______ |
| 0.1molH2O2中极性共价键数目为0.3NA | _______ | _______ |
| Fe(OH)2比Mg(OH)2碱性弱,则可以得到Fe比Mg的金属性弱 | _______ | _______ |
| Na2S+Br2=2NaBr+S,足以证明非金属性Br>S氧化性 | _______ | _______ |
| 1molA能从酸中置换出1.5molH2,1molB能从酸中置换出1molH2,可以证明A比B的金属性强 | _______ | _______ |
| SiO2由固态转化为液态需要克服分子间作用力 | _______ | _______ |
您最近一年使用:0次
名校
2 . 根据已经学过的化学知识,回答下列问题。
I.金属及其化合物在生产生活中有着广泛的应用。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现___________ 性;___________ (填“能”或“不能”)用氢氧化钠溶液代替。
(2)将Cu与稀硫酸混合,二者不能反应,滴入 后,溶液很快变成蓝色,该反应的化学方程式为
后,溶液很快变成蓝色,该反应的化学方程式为___________ 。
(3) 是一种酸式盐,写出
是一种酸式盐,写出 在水中的电离方程式:
在水中的电离方程式:___________ 。
(4)Na2CO3和NaHCO3是厨房中常见的两种盐,可用化学性质的差异进行鉴别。回答下列问题:
①与酸反应的差异。甲组进行了如下4组实验。

其中实验________ 和________ (填实验序号)可以鉴别 和
和 ,实验现象分别是
,实验现象分别是________ 。
②热稳定性差异。乙组设计如下装置进行实验(加热及夹持装置省略)。
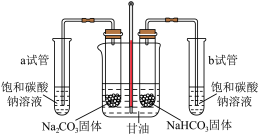
将分别装有 和
和 的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象分别为:
的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象分别为:___________ ,试管b中发生反应的化学方程式为___________ 。
Ⅱ.物质的量是学习化学的基础。
(5)14.4gCO和 的混合气体在标准状况下所占的体积为8.96L,其中CO的质量为
的混合气体在标准状况下所占的体积为8.96L,其中CO的质量为______ 。
(6)19g某二价金属的氯化物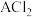 中含有0.4molCl,金属A的相对原子质量是
中含有0.4molCl,金属A的相对原子质量是___________ 。
(7)根据反应 ,可知当有2.5molFeS2参加反应时,被氧化的硫元素的物质的量为
,可知当有2.5molFeS2参加反应时,被氧化的硫元素的物质的量为___________ mol。
I.金属及其化合物在生产生活中有着广泛的应用。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现
(2)将Cu与稀硫酸混合,二者不能反应,滴入
 后,溶液很快变成蓝色,该反应的化学方程式为
后,溶液很快变成蓝色,该反应的化学方程式为(3)
 是一种酸式盐,写出
是一种酸式盐,写出 在水中的电离方程式:
在水中的电离方程式:(4)Na2CO3和NaHCO3是厨房中常见的两种盐,可用化学性质的差异进行鉴别。回答下列问题:
①与酸反应的差异。甲组进行了如下4组实验。

其中实验
 和
和 ,实验现象分别是
,实验现象分别是②热稳定性差异。乙组设计如下装置进行实验(加热及夹持装置省略)。

将分别装有
 和
和 的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象分别为:
的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象分别为:Ⅱ.物质的量是学习化学的基础。
(5)14.4gCO和
 的混合气体在标准状况下所占的体积为8.96L,其中CO的质量为
的混合气体在标准状况下所占的体积为8.96L,其中CO的质量为(6)19g某二价金属的氯化物
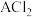 中含有0.4molCl,金属A的相对原子质量是
中含有0.4molCl,金属A的相对原子质量是(7)根据反应
 ,可知当有2.5molFeS2参加反应时,被氧化的硫元素的物质的量为
,可知当有2.5molFeS2参加反应时,被氧化的硫元素的物质的量为
您最近一年使用:0次
名校
3 . I.完成下列问题。
(1)明胶溶于水形成胶体,与溶液相比,胶体最本质的特征是________ 。
A.丁达尔效应 B.分散质直径在1-100nm之间 C.加入电解质会发生沉降
(2)下列方法不能用于鉴别碳酸钠固体和碳酸氢钠固体的是___________。
II.某研究性学习小组查阅资料发现,Na2O2与干燥的HCl气体能发生反应生成Cl2.;Na2O2+4HCl= 2NaCl+Cl2+2H2O。
(3)用双线桥标出该反应电子转移的方向和数目:Na2O2 + 4HCl = 2NaCl + Cl2 + 2H2O________ 。
(4)该反应中氧化剂是___________ (化学式,下同),氧化产物是___________ ,两者氧化性强弱相比,___________ 氧化性更强。
(1)明胶溶于水形成胶体,与溶液相比,胶体最本质的特征是
A.丁达尔效应 B.分散质直径在1-100nm之间 C.加入电解质会发生沉降
(2)下列方法不能用于鉴别碳酸钠固体和碳酸氢钠固体的是___________。
| A.滴加盐酸 | B.溶于水,滴加氯化钙 |
| C.滴加水,测温度变化 | D.溶于水,滴加澄清石灰水 |
II.某研究性学习小组查阅资料发现,Na2O2与干燥的HCl气体能发生反应生成Cl2.;Na2O2+4HCl= 2NaCl+Cl2+2H2O。
(3)用双线桥标出该反应电子转移的方向和数目:Na2O2 + 4HCl = 2NaCl + Cl2 + 2H2O
(4)该反应中氧化剂是
您最近一年使用:0次
2023-11-11更新
|
30次组卷
|
2卷引用:云南省丽江润泽高级中学2023-2024学年高一下学期开学考试化学试题
名校
4 .  和
和 在厨房中很常见,回答下列问题:
在厨房中很常见,回答下列问题:
(1) 从其组成的阴离子来看,属于
从其组成的阴离子来看,属于_______ , 的俗称为
的俗称为_______ ,等物质的量的 和
和 固体中所含的离子总数之比为
固体中所含的离子总数之比为_______ 。
(2)厨房去油污选用 溶液而不选用
溶液而不选用 溶液的原因为
溶液的原因为_______ 。
(3)比较 和
和 的热稳定性的示意图如图,一段时间后,观察到烧杯Ⅱ中的溶液变浑浊了,而烧杯Ⅰ中的溶液未变浑浊。
的热稳定性的示意图如图,一段时间后,观察到烧杯Ⅱ中的溶液变浑浊了,而烧杯Ⅰ中的溶液未变浑浊。
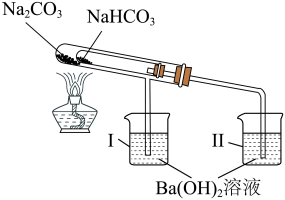
①热稳定性:
_______ (填“>”、“<”或“=”) 。
。
②烧杯Ⅱ中的溶液变浑浊,反应后的产物为_______ (填化学式)。
(4)碳酸氢钠受热分解时转化率与熔烧时间的关系如图。
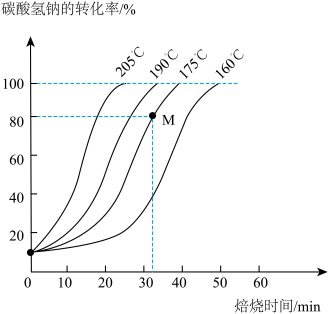
①碳酸氢钠受热分解的化学方程式为_______ 。
②若起始时投入的碳酸氢钠的质量为16.8g(假设不含其他杂质),则M点时产生的二氧化碳气体的体积为_______ L。(气体已换算成标准状况下,转化率 )
)
 和
和 在厨房中很常见,回答下列问题:
在厨房中很常见,回答下列问题:(1)
 从其组成的阴离子来看,属于
从其组成的阴离子来看,属于 的俗称为
的俗称为 和
和 固体中所含的离子总数之比为
固体中所含的离子总数之比为(2)厨房去油污选用
 溶液而不选用
溶液而不选用 溶液的原因为
溶液的原因为(3)比较
 和
和 的热稳定性的示意图如图,一段时间后,观察到烧杯Ⅱ中的溶液变浑浊了,而烧杯Ⅰ中的溶液未变浑浊。
的热稳定性的示意图如图,一段时间后,观察到烧杯Ⅱ中的溶液变浑浊了,而烧杯Ⅰ中的溶液未变浑浊。
①热稳定性:

 。
。②烧杯Ⅱ中的溶液变浑浊,反应后的产物为
(4)碳酸氢钠受热分解时转化率与熔烧时间的关系如图。

①碳酸氢钠受热分解的化学方程式为
②若起始时投入的碳酸氢钠的质量为16.8g(假设不含其他杂质),则M点时产生的二氧化碳气体的体积为
 )
)
您最近一年使用:0次
名校
5 . 小组同学对比 和
和 的性质,进行了如下实验。
的性质,进行了如下实验。
(1)向相同体积、相同浓度的 和
和 溶液中分别滴加
溶液中分别滴加 的盐酸,溶液pH变化如下。
的盐酸,溶液pH变化如下。

①图_______ (填“甲”或“乙”)是 的滴定曲线。
的滴定曲线。
②A′-B′发生反应的离子方程式为_______ 。
③下列说法正确的是_______ (填序号)。
a. 和
和 溶液中所含微粒种类相同
溶液中所含微粒种类相同
b.A、B、C均满足: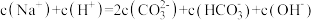
c.水的电离程度: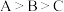
(2)向1mol 的
的 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生。
溶液,均产生白色沉淀,后者有气体产生。
资料:
i.1mol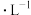 的
的 溶液中,
溶液中, ,
,
ii.25℃时, ,
,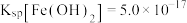
①补全 与
与 反应的离子方程式:
反应的离子方程式:_______ 。

②通过计算说明 与
与 反应产生的沉淀为
反应产生的沉淀为 而不是
而不是
_______ 。
 和
和 的性质,进行了如下实验。
的性质,进行了如下实验。(1)向相同体积、相同浓度的
 和
和 溶液中分别滴加
溶液中分别滴加 的盐酸,溶液pH变化如下。
的盐酸,溶液pH变化如下。
①图
 的滴定曲线。
的滴定曲线。②A′-B′发生反应的离子方程式为
③下列说法正确的是
a.
 和
和 溶液中所含微粒种类相同
溶液中所含微粒种类相同b.A、B、C均满足:
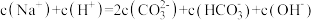
c.水的电离程度:
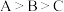
(2)向1mol
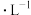 的
的 和
和 溶液中分别滴加少量
溶液中分别滴加少量 溶液,均产生白色沉淀,后者有气体产生。
溶液,均产生白色沉淀,后者有气体产生。资料:
i.1mol
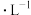 的
的 溶液中,
溶液中, ,
,
ii.25℃时,
 ,
,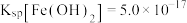
①补全
 与
与 反应的离子方程式:
反应的离子方程式:
②通过计算说明
 与
与 反应产生的沉淀为
反应产生的沉淀为 而不是
而不是
您最近一年使用:0次
2022-11-04更新
|
697次组卷
|
4卷引用:湖北省襄阳市第五中学2022-2023学年高二下学期开学考试化学试题
湖北省襄阳市第五中学2022-2023学年高二下学期开学考试化学试题北京市朝阳区2022-2023学年高三上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(测)-2023年高考化学二轮复习讲练测(新高考专用)北京市第十四中学2023-2024学年高三上学期期中考试化学试题
名校
6 . 纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈__________ 色。
(2)实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是__________ 。
A. 1000mL;21.2g B.950mL;20.14g C.500mL;21.2g D.500mL;10.6g
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为______ 。
(4)某同学为确定一包可能由碳酸钠和碳酸氢钠组成的白色混合物的成分,他取少量该白色物质溶于水,并向所得溶液中加入适量澄清石灰水,产生白色沉淀,据此该同学认为有碳酸钠。你是否同意该同学的观点,请你用适当的化学方程式阐述你的观点________ 。
(5)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:

①曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______ mL。
②曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________ ,其物质的量之比为________ 。
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈
(2)实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是
A. 1000mL;21.2g B.950mL;20.14g C.500mL;21.2g D.500mL;10.6g
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为
(4)某同学为确定一包可能由碳酸钠和碳酸氢钠组成的白色混合物的成分,他取少量该白色物质溶于水,并向所得溶液中加入适量澄清石灰水,产生白色沉淀,据此该同学认为有碳酸钠。你是否同意该同学的观点,请你用适当的化学方程式阐述你的观点
(5)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:

①曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为
②曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是
您最近一年使用:0次
2020-02-14更新
|
256次组卷
|
2卷引用:安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(一)化学试题
名校
解题方法
7 . 碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是___________ ,俗称____________ ,其水溶液显_______ 性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_____________ 。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者_________ 后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为__________________________ 。
(1)碳酸氢钠的化学式是
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为
您最近一年使用:0次
2016-12-08更新
|
778次组卷
|
7卷引用:宁夏青铜峡市高级中学2020-2021学年高一下学期开学考试化学试题
宁夏青铜峡市高级中学2020-2021学年高一下学期开学考试化学试题(已下线)2011-2012学年黑龙江省绥棱县第一中学高一上学期期末考试化学试卷(已下线)2011-2012学年北京市四中高一上学期期末考试化学试卷2015-2016学年湖北省老河口一中高一上学期期末考试化学试卷2015-2016学年河北省保定市望都中学高一上学期期末化学试卷北京市铁路第二中学2020-2021学年高一上学期期中考试化学试题甘肃省镇原县第二中学2020-2021学年高一上学期期末考试化学试题



