1 . 被称为“国防金属”的镁,60%来自海洋,从海水中提取镁的正确方法是
A.海水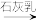 Mg(OH)2 Mg(OH)2 Mg Mg |
B.海水 MgCl2溶液→MgCl2(熔融) MgCl2溶液→MgCl2(熔融) Mg Mg |
C.海水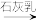 Mg(OH)2 Mg(OH)2 MgO MgO Mg Mg |
D.海水 Mg(OH)2 Mg(OH)2 MgCl2溶液→MgCl2(熔融) MgCl2溶液→MgCl2(熔融) Mg Mg |
您最近一年使用:0次
2 . 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
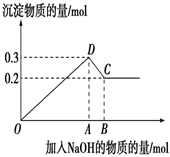
(1)写出代表下列线段发生的反应的离子方程式:
DC段________________________________________________ 。
(2)原溶液中Mg2+、Al3+的物质的量之比为_____________ 。
(3)图中B点时所加入溶液中含NaOH为________ mol
(4)若向50 mL 2 mol·L-1的AlCl3溶液中加入100 mL KOH溶液,充分反应后得到3.12g沉淀。则KOH的物质的量浓度可能为________________________________ 。

(1)写出代表下列线段发生的反应的离子方程式:
DC段
(2)原溶液中Mg2+、Al3+的物质的量之比为
(3)图中B点时所加入溶液中含NaOH为
(4)若向50 mL 2 mol·L-1的AlCl3溶液中加入100 mL KOH溶液,充分反应后得到3.12g沉淀。则KOH的物质的量浓度可能为
您最近一年使用:0次
2018-02-23更新
|
1025次组卷
|
2卷引用:江西省赣州市赣县中学北校区2019-2020学年高一上学期12月月考化学试题
3 . 硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
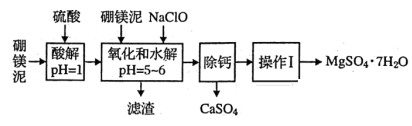
(1)实验中需用1mol/L的硫酸480mL,若用18.4mol/L的浓硫酸来配置,量取浓硫酸时需使用的量筒规格为( ) 。
A 10mL B 20mL C 50mL D 100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________________ ;滤渣中除含有氢氧化铁、氢氧化铝外还有_________ 。
(3)在“除钙”前需检验滤液中Fe3+是否被除尽,简述检验方法_____________________ 。
(4)已知硫酸镁、硫酸钙的溶解度如下表
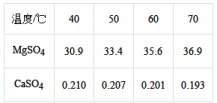
“除钙”是将;硫酸镁和硫酸钙混合溶液中的硫酸钙除去根据上表数据,采取的操作是_______________ 、趁热过滤、_________ 、____________ ,便得到比较纯净的硫酸镁。
(5)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________________ 。

(1)实验中需用1mol/L的硫酸480mL,若用18.4mol/L的浓硫酸来配置,量取浓硫酸时需使用的量筒规格为
A 10mL B 20mL C 50mL D 100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-还有一种离子也会被NaClO氧化,该反应的离子方程式为
(3)在“除钙”前需检验滤液中Fe3+是否被除尽,简述检验方法
(4)已知硫酸镁、硫酸钙的溶解度如下表

“除钙”是将;硫酸镁和硫酸钙混合溶液中的硫酸钙除去根据上表数据,采取的操作是
(5)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为
您最近一年使用:0次
2018-12-17更新
|
782次组卷
|
2卷引用:【校级联考】天津市静海区2019届高三上学期三校联考化学试题
名校
4 . 加热蒸干氯化镁溶液时因水解不完全会得到一种灰白色沉淀——碱式氯化镁,化学式可表示为Mgx(OH)yClz·nH2O,设计如图所示装置验证其化学式。下列有关实验的说法不正确的是( )。
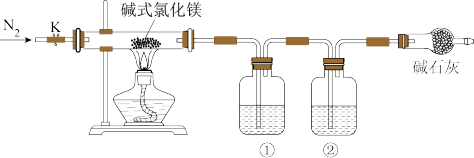

| A.①②中依次盛装浓硫酸、氢氧化钠溶液 |
| B.反应结束时,先停止加热,通一段时间N2后再关闭活塞K |
| C.碱式氯化镁受热分解可以产生氧化镁、氯气和水 |
| D.只需称取原样品质量、反应结束后硬质玻璃管中剩余固体质量以及装置①增加的质量即可推出其化学式 |
您最近一年使用:0次
2020-09-19更新
|
427次组卷
|
4卷引用:河南省南阳市第一中学2021届高三上学期第二次月考(9月)化学试题
河南省南阳市第一中学2021届高三上学期第二次月考(9月)化学试题黑龙江省哈尔滨市宾县第一中学2020-2021学年高一上学期第三次月考化学试题(已下线)课时15 镁及其化合物-2022年高考化学一轮复习小题多维练(全国通用)上海市大同中学2021-2022学年高三下学期4月线上期中考试化学试题
5 . 已知A~O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B元素为第三周期第IIA族。J常温下为液体。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
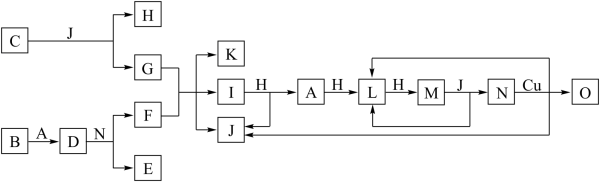
请回答下列问题:
(1)D为_______ 。(填化学式)
(2)I的沸点比PH3的沸点高,其原因是_______ 。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:_______ 。
(4)写出N与FeO反应的离子方程式:_______ 。
(5)F中阳离子的检验步骤是_______ 。

请回答下列问题:
(1)D为
(2)I的沸点比PH3的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出N与FeO反应的离子方程式:
(5)F中阳离子的检验步骤是
您最近一年使用:0次
名校
6 . 在给定条件下,下列选项所示的物质间转化均能实现的是
A.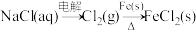 |
B. |
C. |
D. |
您最近一年使用:0次
2021-10-10更新
|
249次组卷
|
4卷引用:辽宁省沈阳市郊联体2022届高三10月月考化学试题
7 . 下列说法正确的是
A.工业上用软锰矿(主要成分 )在加热条件下与浓盐酸反应制氯气 )在加热条件下与浓盐酸反应制氯气 |
| B.工业上用二氧化硅在高温下与焦炭反应可直接得到高纯度的硅 |
| C.工业上用熔融氧化镁制单质镁 |
| D.在硫酸工业的吸收塔中,采用浓硫酸吸收三氧化硫 |
您最近一年使用:0次
8 . 现有100 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol/L,c(Cl-)=1.0 mol/L,要使Mg2+转化为Mg(OH)2,并使Mg2+与Al3+分离开,至少需要2 mol/L的NaOH溶液的体积为
| A.40 mL | B.120 mL |
| C.100 mL | D.60 mL |
您最近一年使用:0次
2021-01-06更新
|
308次组卷
|
2卷引用:陕西师范大学附属中学2023-2024学年高一上学期12月月考化学试题
2018高三上·全国·专题练习
名校
9 . 镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。
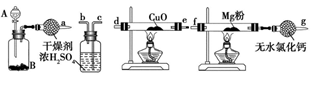
①A中盛装的是浓氨水,B中可盛装___ ,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___ 、___ 接___ 、___ 接___ 。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________ 。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________ 。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____ 。
②步骤3中加氨水后反应的离子方程式为______________ 。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
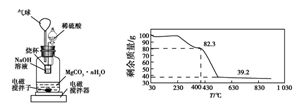
③图中气球的作用是__________________ 。
④上述反应后期要升温到30 ℃,主要目的是________________ 。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___ (用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______ 。
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。

①A中盛装的是浓氨水,B中可盛装
②按照气流的方向从左至右连接装置:a接
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
②步骤3中加氨水后反应的离子方程式为
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。

③图中气球的作用是
④上述反应后期要升温到30 ℃,主要目的是
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=
您最近一年使用:0次
2018-11-23更新
|
839次组卷
|
3卷引用:湖南省常德市芷兰实验学校2020届高三第二次月考化学试题
湖南省常德市芷兰实验学校2020届高三第二次月考化学试题(已下线)2018年11月25日 《每日一题》 人教版一轮复习-每周一测【全国百强校】湖南省长沙市长郡中学2019届高三上学期第五次调研考试化学试题
名校
10 . 以下物质之间的每步转化中,都能通过一步反应实现的个数是
①Fe→FeCl2→Fe(OH)2→Fe(OH)3;
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2;
④Al→Al2O3→Al(OH)3;
⑤Al→NaAlO2→Na2CO3
①Fe→FeCl2→Fe(OH)2→Fe(OH)3;
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2;
④Al→Al2O3→Al(OH)3;
⑤Al→NaAlO2→Na2CO3
| A.2个 | B.3个 | C.4个 | D.5个 |
您最近一年使用:0次
2022-12-26更新
|
253次组卷
|
2卷引用:湖北省武汉市第六中学2021-2022学年高一上学期12月月考化学试题



