名校
1 . 下列实验目的、实验操作及现象与对应结论都正确的是
选项 | 实验目的 | 实验操作及现象 | 结论 |
A | 检验蔗糖是否水解 | 向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的 ,无砖红色沉淀 ,无砖红色沉淀 | 蔗糖未发生水解 |
B | 探究镁和铝的金属活泼性 | 向盛有浓 溶液的两支试管中分别加入除去氧化膜的镁带和铝片,加入镁带的试管中迅速产生红棕色气体,加入铝片试管中无明显现象 溶液的两支试管中分别加入除去氧化膜的镁带和铝片,加入镁带的试管中迅速产生红棕色气体,加入铝片试管中无明显现象 | 金属活泼性: 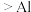 |
C | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向 溶液中缓慢滴加浓硫酸,溶液黄色变为橙红色 溶液中缓慢滴加浓硫酸,溶液黄色变为橙红色 | 增大氢离子浓度,平衡向生成 的方向移动 的方向移动 |
D | 探究在相同条件下 和 和 的溶解度大小 的溶解度大小 | 向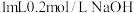 溶液中滴入2滴 溶液中滴入2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,又生成红褐色沉淀 溶液,又生成红褐色沉淀 | 证明在相同条件下,溶解度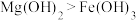 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
2 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计与结论都正确的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 检验固体样品中是否含有NH | 将固体样品加水溶解,滴入浓NaOH溶液并加热,试管口放一张湿润的红色石蕊试纸 | 湿润的红色石蕊试纸变蓝 | 样品中含有NH |
| B | 探究铝与浓硫酸的钝化现象 | 室温下,将铝片直接放入浓硫酸中,一段时间后取出并用水洗净,放入CuSO4溶液 | 铝片表面未见紫红色固体生成 | 室温下浓硫酸能将铝片钝化 |
| C | 探究Si、Cl元素非金属性的强弱 | 向Na2SiO3溶液中滴加1滴酚酞,然后逐滴加入盐酸至红色褪去 | 混合液逐渐变成白色凝胶 | 非金属性:Si<Cl |
| D | 探究浓度与反应速率的关系 | 两支试管各盛4mL 0.01mol/L酸性高锰酸钾溶液,分别加入2mL 0.1mol/L草酸溶液和2mL 0.2mol/L草酸溶液 | 加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液褪色更快 | 反应物浓度越大,反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
3 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 比较CH3COO−和HCO 的水解常数 的水解常数 | 分别测定浓度均为0.1mol·L−1的CH3COONH4和NaHCO3溶液的pH,后者大于前者 | Kh(CH3COO−)<Kh(HCO ) ) |
| B | 探究Fe3+、Cu2+对H2O2分解的催化作用 | 在a、b两支试管中分别加入2mL5% H2O2溶液,分别滴入0.2mol·L−1FeCl3溶液、0.3mol·L−1CuCl2溶液各0.5mL,a中冒出气泡速率比b快 | 催化作用:Fe3+>Cu2+ |
| C | 比较AgCl、AgI的溶度积 | 在含0.1mol的AgNO3溶液中依次加入NaCl溶液和NaI溶液,先有白色沉淀生成,后来又变成黄色 | Ksp(AgCl)>Ksp(AgI) |
| D | 验证Al、Cu的活泼性 | 将相同大小的铜片、铝片用导线连接,平行放入浓硝酸中,铜片不断溶解 | 活泼性:Al<Cu |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-12-13更新
|
195次组卷
|
3卷引用:山西省晋城市第二中学校2022-2023学年高二上学期12月月考化学试题
名校
4 . 化学是一门实验性的学科,下列有关化学实验的操作、预期现象和结论(或实验目的)均正确的是
| 选项 | 操作 | 预期现象 | 实验结论或目的 |
| A | 两支试管中先后分别加入2mL 0.1mol/LKI溶液和2mL 0.5mol/LH2SO4溶液及3滴淀粉溶液,再分别加入热水与冷水中 | 放入热水中的试管溶液先变蓝 | 探究温度对化学反应速率的影响 |
| B | 常温下,向浓硫酸中投入铝片 | 铝片不溶解 | 常温下,铝不与浓硫酸反应 |
| C | 向装有几片新鲜玫瑰花瓣的集气瓶中通入过量的干燥氯气 | 鲜花未褪色 | Cl2没有漂白性 |
| D | 向某无色溶液中先加入过量盐酸,再加入氯化钡溶液 | 先无明显现象,后有白色沉淀生成 | 溶液中有SO42- |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2020-04-04更新
|
317次组卷
|
2卷引用:四川省成都市蓉城名校联盟2020届高三第二次联考(全国III)理综化学试题
5 . 利用下列装置和试剂进行实验,能达到实验目的的是
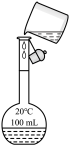 | 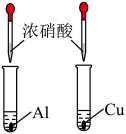 | 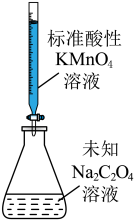 |  |
| A.向容量瓶中转移溶液 | B.比较Al和Cu的金属活动性 | C.测定未知Na2C2O4溶液的浓度 | D.中和反应反应热的测定 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
6 . 下列实验能达到实验目的的是
选项 | 实验 | 目的 |
A | 常温下,铝、铜在浓硝酸中构成原电池 | 证明铝比铜活泼 |
B | 苯和溴水、溴化铁混合 | 制备溴苯 |
C | 将含少量CO2的CO气体通过过氧化钠 | 提纯CO气体 |
D | 向FeSO4,溶液中滴加NH4SCN溶液 | 检验FeSO4,是否变质 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7 . 已知草酸晶体(H2C2O4·2H2O)的熔点为 101℃,170℃分解。下列选用的装置和药品能达到实验目的的是( )
| A | B | C | D |
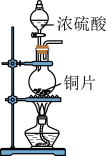 |  | 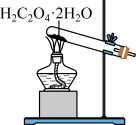 | 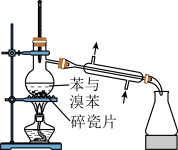 |
| 制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2019-04-29更新
|
252次组卷
|
8卷引用:河南省洛阳市2018届高三上学期第一次质量预测(1月)化学试题
8 . 下列通过制取硫酸铝、氢氧化铝,获得氧化铝的装置和原理能达到实验目的的是
A.制硫酸铝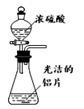 | B.制氢氧化铝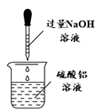 | C.过滤氢氧化铝 | D.灼烧制氧化铝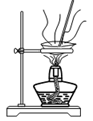 |
您最近半年使用:0次
2018-04-03更新
|
1052次组卷
|
8卷引用:江苏省南通、徐州、扬州、泰州、淮安、宿迁六市2018届高三第二次调研(二模)化学试题
名校
解题方法
9 . 以下是有关铝的实验探究,请回答相关问题:
(1)用铝粉和 Fe2O3做铝热反应实验,需要的试剂还有___________。
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和 Fe2O3反应的化学方程式___________ 。
(3)向集满CO2的铝制易拉罐中加入过量 NaOH 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪; 再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:___________ 。
(4)向铝粉中添加少量 NH4Cl固体并充分混合,将其加热到1000℃时可与 N₂反应制备 AlN,下列说法正确的是___________
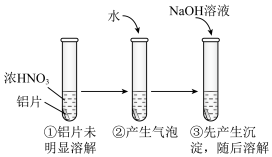
(5)用打磨过的铝片进行如下实验, 下列分析不合理的是___________
(6)为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
下列说法不正确的是___________
(7)某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和 SiO2杂质。称取 17.50g铝土矿样品,加入 200mL1.65mol/L 的稀硫酸,恰好完全反应,过滤得沉淀0.30g,然后在滤液中加入足量的 NaOH 溶液,得到沉淀 2.14g。
①该试样中Fe2O3的物质的量为___________ mol。
② 样品中Al2O3·xH2O的x=__________ 。
(1)用铝粉和 Fe2O3做铝热反应实验,需要的试剂还有___________。
| A.KCl | B.KClO3 | C.MnO2 | D.Mg |
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和 Fe2O3反应的化学方程式
(3)向集满CO2的铝制易拉罐中加入过量 NaOH 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪; 再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:
(4)向铝粉中添加少量 NH4Cl固体并充分混合,将其加热到1000℃时可与 N₂反应制备 AlN,下列说法正确的是___________
| A.AlN是一种金属材料 |
| B.AlN与足量氢氧化钠溶液共热时生成氢氧化铝和氨气 |
| C.少量 NH4Cl能够破坏 Al表面的 Al2O3薄膜 |
| D.AlN与足量盐酸反应的离子方程式为AlN+3H+=Al3++NH3↑ |
(5)用打磨过的铝片进行如下实验, 下列分析不合理的是___________

| A.①中铝片发生了钝化 |
| B.②中产生的气泡是氮氧化合物,不是氢气 |
| C.③中沉淀溶解的离子方程式是Al(OH)3+OH-=[Al(OH)4]- |
| D.②中加水稀释过程中,仅发生了氧化还原反应 |
(6)为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
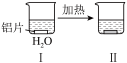 |  | |
| 无明显现象 | 铝片表面产生细小气泡 | 出现白色沉淀,产生大量气泡(经检验为H2和CO2) |
A.Na2CO3溶液中存在水解平衡: 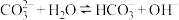 |
| B.对比Ⅰ 、Ⅲ,推测 Na2CO3溶液能破坏铝表面的氧化膜 |
| C.Ⅳ溶液中可能存在大量 Al3+ |
D.推测出现白色浑浊的可能原因:[Al(OH)4]-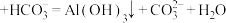 |
(7)某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和 SiO2杂质。称取 17.50g铝土矿样品,加入 200mL1.65mol/L 的稀硫酸,恰好完全反应,过滤得沉淀0.30g,然后在滤液中加入足量的 NaOH 溶液,得到沉淀 2.14g。
①该试样中Fe2O3的物质的量为
② 样品中Al2O3·xH2O的x=
您最近半年使用:0次
10 . 按照如图所示装置,打开分液漏斗的塞子和旋塞,将液体逐滴加入到锥形瓶中,(2)中的现象和结论都正确的是
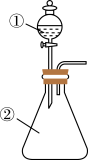

| 选项 | ①中物质 | ②中物质 | ②中的现象 | 结论 |
| A | 稀硫酸 | 苏打粉末 | 立即产生大量气体 | 硫元素的非金属性比碳元素强 |
| B | 浓硝酸 | 用砂纸打磨过的铁片 | 产生红棕色气体 | 铁能将浓硝酸还原为NO2 |
| C | 氯化铝溶液 | 氢氧化钠溶液 | 立即产生大量白色沉淀 | Al(OH)3不溶于强碱溶液 |
| D | 双氧水 | 二氧化锰粉末 | 立即产生气体 | 二氧化锰是还原剂 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



