2023高三·全国·专题练习
解题方法
1 . 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2晶体已氧化变质。(_______)
您最近一年使用:0次
解题方法
2 . 为探究某绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案。
可供选择的试剂:硫氰化钾溶液、酸性高锰酸钾溶液、氯水、氢氧化钠溶液、氯化钡溶液,请参与完成方案设计。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)如何证明绿矾已经被氧化_______ 。
(2)如何证明绿矾已经被完全氧化_______ 。
(3)在使用硫酸亚铁时,如何防止 的干扰?写出相关离子方程式
的干扰?写出相关离子方程式_______ 。
可供选择的试剂:硫氰化钾溶液、酸性高锰酸钾溶液、氯水、氢氧化钠溶液、氯化钡溶液,请参与完成方案设计。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)如何证明绿矾已经被氧化
(2)如何证明绿矾已经被完全氧化
(3)在使用硫酸亚铁时,如何防止
 的干扰?写出相关离子方程式
的干扰?写出相关离子方程式
您最近一年使用:0次
2023·上海·模拟预测
3 . 过氧化氢和盐酸的混合溶液可以刻蚀含铜的电路板。
(1)请写出用过氧化氢和盐酸刻蚀电路板时发生的离子反应方程式:_______ 。当反应一段时间后,随着溶液变蓝,气泡产生的速率加快,其可能的原因是_______ 。
含铜电路板也可以用 进行刻蚀,对刻蚀后的液体(
进行刻蚀,对刻蚀后的液体( 、
、 和
和 )进行处理以提取和
)进行处理以提取和 ,流程如下图所示:
,流程如下图所示:
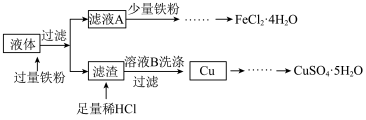
(2)从滤液A中提取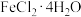 的操作为:加入Fe粉后,应先浓缩滤液至出现
的操作为:加入Fe粉后,应先浓缩滤液至出现_______ ,趁热过滤,取溶液,_______ ,过滤、洗涤、干燥。
(3)检验溶液B中提取出的Cu上粘附的 已经洗净的操作为:
已经洗净的操作为:_______ ,制备 时,将铜溶解于
时,将铜溶解于 、
、 的混酸中,此过程中产生的红棕色气体为
的混酸中,此过程中产生的红棕色气体为_______ 产物(选填“氧化”或“还原”)。
利用滴定法可测定所得 的纯度,操作如下:
的纯度,操作如下:
①取a g 样品,加入足量
样品,加入足量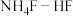 溶液溶解(其中用于防止
溶液溶解(其中用于防止 干扰检验:
干扰检验: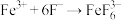 )
)
②滴加足量KI溶液,发生反应
③再用c mol·L
 标准溶液滴定,以淀粉溶液作指示剂,到达滴定终点时消耗硫代硫酸钠标准液V mL,发生的反应为:
标准溶液滴定,以淀粉溶液作指示剂,到达滴定终点时消耗硫代硫酸钠标准液V mL,发生的反应为: ,
,
(4)已知 溶液呈酸性,则水解程度
溶液呈酸性,则水解程度
_______  (填“>”、“<”或“=”),稀释后溶液中,
(填“>”、“<”或“=”),稀释后溶液中, 的值
的值_______ (选填“增大”、“减小”或“不变”)。
(5)接近滴定终点时,向溶液中滴加KSCN溶液,会发现CuI沉淀转化为CuSCN,其沉淀转化的原因是_______ 。已知CuI能够吸附大量 ,若不加KSCN,则测得
,若不加KSCN,则测得 的纯度
的纯度_______ (选填“偏高”、“偏低”或“不变”)。
(6)计算 的纯度:
的纯度:_______ (用a、c、V的代数式表示)。
(1)请写出用过氧化氢和盐酸刻蚀电路板时发生的离子反应方程式:
含铜电路板也可以用
 进行刻蚀,对刻蚀后的液体(
进行刻蚀,对刻蚀后的液体( 、
、 和
和 )进行处理以提取和
)进行处理以提取和 ,流程如下图所示:
,流程如下图所示:
(2)从滤液A中提取
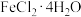 的操作为:加入Fe粉后,应先浓缩滤液至出现
的操作为:加入Fe粉后,应先浓缩滤液至出现(3)检验溶液B中提取出的Cu上粘附的
 已经洗净的操作为:
已经洗净的操作为: 时,将铜溶解于
时,将铜溶解于 、
、 的混酸中,此过程中产生的红棕色气体为
的混酸中,此过程中产生的红棕色气体为利用滴定法可测定所得
 的纯度,操作如下:
的纯度,操作如下:①取a g
 样品,加入足量
样品,加入足量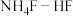 溶液溶解(其中用于防止
溶液溶解(其中用于防止 干扰检验:
干扰检验: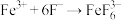 )
)②滴加足量KI溶液,发生反应

③再用c mol·L

 标准溶液滴定,以淀粉溶液作指示剂,到达滴定终点时消耗硫代硫酸钠标准液V mL,发生的反应为:
标准溶液滴定,以淀粉溶液作指示剂,到达滴定终点时消耗硫代硫酸钠标准液V mL,发生的反应为: ,
, (4)已知
 溶液呈酸性,则水解程度
溶液呈酸性,则水解程度
 (填“>”、“<”或“=”),稀释后溶液中,
(填“>”、“<”或“=”),稀释后溶液中, 的值
的值(5)接近滴定终点时,向溶液中滴加KSCN溶液,会发现CuI沉淀转化为CuSCN,其沉淀转化的原因是
 ,若不加KSCN,则测得
,若不加KSCN,则测得 的纯度
的纯度(6)计算
 的纯度:
的纯度:
您最近一年使用:0次
名校
解题方法
4 . 下列方案设计、现象和结论有不正确 的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验海带中是否含有碘元素 | 将海带灰溶解过滤后,取适量滤液于试管中,酸化后加入少量新制氯水,充分反应后加入1~2滴淀粉溶液 | 溶液变蓝,则证明海带中含有碘元素 |
| B | 鉴定淀粉是否完全水解 | 取少量淀粉于锥形瓶中,以固液比1∶10加入稀硫酸,牛皮纸封口,在120℃下水解30min,取适量水解液于试管中,加入少量碘-碘化钾溶液 | 溶液未变蓝,则证明淀粉已完全水解 |
| C | 检验CO还原 的生成物中是否含有 的生成物中是否含有 | 将适量反应后的固体溶于稀盐酸中,取少量溶解液于试管中,滴加硫氰化钾溶液 | 溶液变血红色,则证明还原产物中含有 |
| D | 检验食盐中是否混有少量亚硝酸钠 | 取适量食盐样品于试管中,加水溶解后加入硝酸银溶液,过滤后取滤渣,滴加稀硝酸 | 若沉淀部分溶解,则证明食盐中混有亚硝酸钠 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-14更新
|
789次组卷
|
7卷引用:2022年浙江省6月高考真题变式题21-25
(已下线)2022年浙江省6月高考真题变式题21-25浙江省金华十校2021-2022学年高三下学期4月模拟考试化学试题(已下线)押江苏卷第11题 化学实验综合选择题 -备战2022年高考化学临考题号押题(江苏卷)江苏省淮安市钦工中学2022-2023学年高三上学期第一次月考化学试题江苏省徐州市第七中学2022-2023学年高三上学期9月摸底学情调研化学试题湖南省攸县第二中学2022-2023学年高三第六次月考化学试题湖南省攸县第一中学2022-2023学年高三第六次月考化学试题
5 . 硫氰化铵(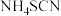 )可以作为聚合反应和过氧化氢生产的催化剂,某化学实验小组在实验室条件下模拟制备少量样品,常压下的制备原理为:
)可以作为聚合反应和过氧化氢生产的催化剂,某化学实验小组在实验室条件下模拟制备少量样品,常压下的制备原理为:
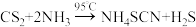 。
。
步骤1:将装置Ⅰ中药品A以恒定的速度滴入装有药品B的烧瓶中,确保有稳定的氨气缓慢通入装置Ⅱ;
步骤2:装置Ⅱ加热至95°C,发生反应,观察到装置Ⅱ下层液体逐渐减少,直至近乎消失时停止通入氨气。

回答下列问题:
(1)仪器a的名称为___________ 。装置Ⅰ中所盛装的药品A、B分别为___________ 。
(2)装置Ⅱ中加入 的目的是
的目的是___________ 。
(3)反应开始后,为加快反应速率同时控制反应温度,装置Ⅱ可以采用的加热方式是___________ 。
(4)装置Ⅲ中盛放的溶液可以是___________ ,发生反应的离子方程式为___________ 。
(5)该实验小组同学为检验生成的产物,设计了如下实验探究。
①取少量Ⅱ中反应后的溶液于试管中,滴加___________ 溶液,振荡,出现现象___________ ,得出结论产物中含有 。
。
②设计实验证明产物中存在 :
:___________ (简述实验操作及现象)。
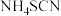 )可以作为聚合反应和过氧化氢生产的催化剂,某化学实验小组在实验室条件下模拟制备少量样品,常压下的制备原理为:
)可以作为聚合反应和过氧化氢生产的催化剂,某化学实验小组在实验室条件下模拟制备少量样品,常压下的制备原理为: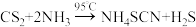 。
。步骤1:将装置Ⅰ中药品A以恒定的速度滴入装有药品B的烧瓶中,确保有稳定的氨气缓慢通入装置Ⅱ;
步骤2:装置Ⅱ加热至95°C,发生反应,观察到装置Ⅱ下层液体逐渐减少,直至近乎消失时停止通入氨气。

回答下列问题:
(1)仪器a的名称为
(2)装置Ⅱ中加入
 的目的是
的目的是(3)反应开始后,为加快反应速率同时控制反应温度,装置Ⅱ可以采用的加热方式是
(4)装置Ⅲ中盛放的溶液可以是
(5)该实验小组同学为检验生成的产物,设计了如下实验探究。
①取少量Ⅱ中反应后的溶液于试管中,滴加
 。
。②设计实验证明产物中存在
 :
:
您最近一年使用:0次
解题方法
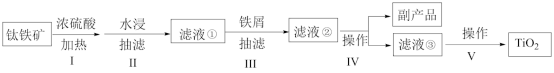
6 . 钛白粉(主要成分是 ),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁
),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁 ,含
,含 杂质]为主要原料生产钛白粉并获得副产品
杂质]为主要原料生产钛白粉并获得副产品 的工艺流程图。
的工艺流程图。
已知:发生的主要反应方程式如下:
①
②
③
(1)为加快钛铁矿在硫酸中的溶解,可采取的措施有______ 。
(2)下列说法正确的是_______ 。
A.步骤Ⅱ抽滤得到的滤渣是
B.步骤Ⅱ水浸时温度不宜过高,否则会导致 产率降低
产率降低
C.步骤Ⅱ、Ⅲ抽滤时选用的滤纸要小于布氏漏斗内径,但必须盖住所有小孔
D.步骤Ⅲ加铁屑的作用是将 还原为
还原为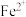 ,以获得较纯净的副产品
,以获得较纯净的副产品
(3)步骤V包括钛盐的水解、产物的分离和物质的转化。操作步骤如下:_____→_____→____→____→将滤渣在坩埚中充分灼烧得到二氧化钛(TiO2),_____ 。
①将下列操作按合理顺序填入以上空格。
a.用滤液淋洗锥形瓶,直到所有的沉淀被收集到布氏漏斗中,继续抽滤;
b.将滤液③加到盛有沸水的锥形瓶中,搅拌、煮沸;
c.用水洗涤沉淀2-3次,再抽干水分;
d.将悬浊液转移到布氏漏斗中抽滤;
②关于上述灼烧操作,下列相关说法正确的是_______
A.坩埚洗净擦干后,即可加入固体灼烧
B.将盛有固体的坩埚放在三脚架的石棉网上加热
C.灼烧固体过程中,需要不断搅拌
D.判断固体是否完全分解,可以重复灼烧、冷却、称量至恒重
(4)测定样品中TiO2纯度的方法是:
步骤一:精确称取0.2000g样品放入锥形瓶中,一定条件下,将TiO2溶解并还原为Ti3+。
步骤二:称取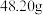 硫酸铁铵
硫酸铁铵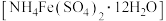 配制成
配制成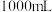 硫酸铁铵标准溶液。
硫酸铁铵标准溶液。
步骤三:滴加 溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知:
溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知: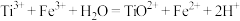 )。
)。
请回答:
①样品中TiO2的质量分数为_____ 。
②步骤三滴定过程中速度过慢,将导致测定结果_ (填“偏高”“偏低”或“无影响”)。请说明理由_ 。
 ),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁
),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁 ,含
,含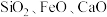 杂质]为主要原料生产钛白粉并获得副产品
杂质]为主要原料生产钛白粉并获得副产品 的工艺流程图。
的工艺流程图。
已知:发生的主要反应方程式如下:
①

②

③

(1)为加快钛铁矿在硫酸中的溶解,可采取的措施有
(2)下列说法正确的是
A.步骤Ⅱ抽滤得到的滤渣是

B.步骤Ⅱ水浸时温度不宜过高,否则会导致
 产率降低
产率降低C.步骤Ⅱ、Ⅲ抽滤时选用的滤纸要小于布氏漏斗内径,但必须盖住所有小孔
D.步骤Ⅲ加铁屑的作用是将
 还原为
还原为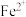 ,以获得较纯净的副产品
,以获得较纯净的副产品
(3)步骤V包括钛盐的水解、产物的分离和物质的转化。操作步骤如下:_____→_____→____→____→将滤渣在坩埚中充分灼烧得到二氧化钛(TiO2),
①将下列操作按合理顺序填入以上空格。
a.用滤液淋洗锥形瓶,直到所有的沉淀被收集到布氏漏斗中,继续抽滤;
b.将滤液③加到盛有沸水的锥形瓶中,搅拌、煮沸;
c.用水洗涤沉淀2-3次,再抽干水分;
d.将悬浊液转移到布氏漏斗中抽滤;
②关于上述灼烧操作,下列相关说法正确的是
A.坩埚洗净擦干后,即可加入固体灼烧
B.将盛有固体的坩埚放在三脚架的石棉网上加热
C.灼烧固体过程中,需要不断搅拌
D.判断固体是否完全分解,可以重复灼烧、冷却、称量至恒重
(4)测定样品中TiO2纯度的方法是:
步骤一:精确称取0.2000g样品放入锥形瓶中,一定条件下,将TiO2溶解并还原为Ti3+。
步骤二:称取
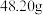 硫酸铁铵
硫酸铁铵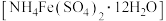 配制成
配制成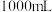 硫酸铁铵标准溶液。
硫酸铁铵标准溶液。步骤三:滴加
 溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知:
溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知: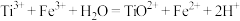 )。
)。请回答:
①样品中TiO2的质量分数为
②步骤三滴定过程中速度过慢,将导致测定结果
您最近一年使用:0次



