2024高三下·全国·专题练习
解题方法
1 . 探究pH对 溶液的配制和保存的影响。
溶液的配制和保存的影响。
I. 溶液的配制
溶液的配制
将 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
II. 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
(1)①中的浑浊主要是FeOOH,用离子方程式表示其生成过程_______ 。
(2)该实验的初步结论:保存 溶液的最佳pH是
溶液的最佳pH是_______ 。
(3)进一步探究pH对 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;
ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因_______ 。
b.依据实验i和ii推断:③比②中 更易变质的原因是
更易变质的原因是_______ 。
c.按上述原理进行实验,证实①中 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,_______ 。
 溶液的配制和保存的影响。
溶液的配制和保存的影响。I.
 溶液的配制
溶液的配制将
 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:| 编号 | 溶剂 | 溶液性状 | |
| ① | 蒸馏水 | 浅黄色澄清溶液 |  ;滴加1mol/LKSCN溶液无明显变化 ;滴加1mol/LKSCN溶液无明显变化 |
| ② |  | 无色澄清溶液 |  ;滴加1mol/LKSCN溶液微微变红 ;滴加1mol/LKSCN溶液微微变红 |
| ③ |  | 无色澄清溶液 | 滴加1mol/LKSCN溶液微微变红 |
 溶液的保存
溶液的保存将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
| 编号 | 溶液性状 | |
| ① | 橙色浑浊 | 用 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 |
| ② | 无色溶液 | 滴加1mol/L的KSCN溶液后显浅红色 |
| ③ | 无色溶液 | 滴加1mol/L的KSCN溶液后显红色,颜色比②略深 |
(2)该实验的初步结论:保存
 溶液的最佳pH是
溶液的最佳pH是(3)进一步探究pH对
 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: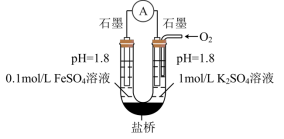
 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因
b.依据实验i和ii推断:③比②中
 更易变质的原因是
更易变质的原因是c.按上述原理进行实验,证实①中
 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
您最近一年使用:0次
名校
2 . W是由A、B两种元素组成的AB2型化合物。
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。则W为________________ (填化学式)。
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象。往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色。
①W溶液中所含金属阳离子为________________ 。
②上述实验中,W与足量氯水反应的离子方程式为_________________________________________________________ 。
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1∶1。
①阴离子的电子式为___________________ 。
②1mol W与足量水充分反应,转移电子的物质的量为_____________ mol。
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸。
①B在元素周期表中的位置为______________________________ 。
②如果常温下W为气体,W所形成的二元弱酸溶液中,含A元素的某微粒占所有含A元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为______________________ ;
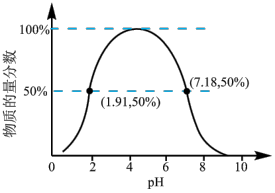
该二元弱酸的一级电离常数为Ka1,则pKa1=—lgKa1≈______________________ 。
③如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为_________________ 。
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛。则W为
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象。往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色。
①W溶液中所含金属阳离子为
②上述实验中,W与足量氯水反应的离子方程式为
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1∶1。
①阴离子的电子式为
②1mol W与足量水充分反应,转移电子的物质的量为
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸。
①B在元素周期表中的位置为
②如果常温下W为气体,W所形成的二元弱酸溶液中,含A元素的某微粒占所有含A元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为

该二元弱酸的一级电离常数为Ka1,则pKa1=—lgKa1≈
③如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为
您最近一年使用:0次
3 . 铁及其化合物与生产、生活关系密切,请回答下列问题:
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:__ __。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:_________________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因: 。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:__ 。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示

①写出(a+10)到(a+20)过程中反应的离子方程式:___________________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)= mol
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:__ __。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:_________________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因: 。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:__ 。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和Na2SO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示

①写出(a+10)到(a+20)过程中反应的离子方程式:___________________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)= mol
您最近一年使用:0次
4 . 采用32%~35%的FeCl3溶液腐蚀印刷线路板上的金属铜,腐蚀废液中主要含有CuCl2、FeCl2和HCl等溶质。
(1)用FeCl3溶液溶解印刷线路板上金属铜的化学方程式为_______ 。
(2)工业上用铁粉回收腐蚀废液中的铜,方法如下:
①用铁粉回收铜的操作为:加入过量铁粉,充分搅拌,过滤、洗涤、_______ 。
②科学家对铁置换铜的工艺有如下研究:
分别在a、b、c三种条件下回收腐蚀废液中的铜,取充分反应后的粉末各3.000 g分别放入甲、乙、丙三个烧杯中,再加入100 mL 0.5mol·L-1的硫酸,水浴加热(70 ℃),搅拌,进行除铁处理。分别在第10、20、30、40、50 min时,用吸管移取0.5 g左右的铜试样于试管内,测定铜粉中铁的含量(质量分数),其结果如图所示。

你认为除铁效果最好的是_______ (填“a”、“b”或“c”),其原因是_______ 。
(3)工业上可用腐蚀废液制备CuCl2·2H2O,从而进行对废液的利用,其工艺流程如图:
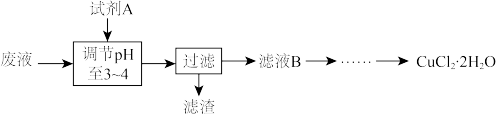
部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
试剂A最好应选用_______ (填写字母代号),理由是_______ 。
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液
(1)用FeCl3溶液溶解印刷线路板上金属铜的化学方程式为
(2)工业上用铁粉回收腐蚀废液中的铜,方法如下:
①用铁粉回收铜的操作为:加入过量铁粉,充分搅拌,过滤、洗涤、
②科学家对铁置换铜的工艺有如下研究:
分别在a、b、c三种条件下回收腐蚀废液中的铜,取充分反应后的粉末各3.000 g分别放入甲、乙、丙三个烧杯中,再加入100 mL 0.5mol·L-1的硫酸,水浴加热(70 ℃),搅拌,进行除铁处理。分别在第10、20、30、40、50 min时,用吸管移取0.5 g左右的铜试样于试管内,测定铜粉中铁的含量(质量分数),其结果如图所示。

你认为除铁效果最好的是
(3)工业上可用腐蚀废液制备CuCl2·2H2O,从而进行对废液的利用,其工艺流程如图:

部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 |
| 完全沉淀 | 4.1 | 9.7 | 6.7 |
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液
您最近一年使用:0次



