1 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是______ 。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为______ 。
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于______ (填字母代号)。
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:______ ;能使该反应发生的可能原因是______ 。
II.已知: 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色
在溶液中为黄色
(1)下列反应曾用于检测司机是否酒后驾驶:2 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
①基态Cr原子外围电子排布图为______ ;配合物[Cr(H2O)6]3+中与Cr3+形成配位键的原子是______ (填元素符号)。
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为______ 。
(2)有下列实验:
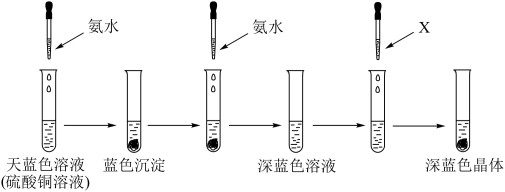
①呈天蓝色的离子的化学式为______ ,溶剂X可以是______ (填名称),继续添加氨水,沉淀溶解的离子方程式为______ 。
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是______ 。
③下列有关化学实验的“操作→现象→解释”均正确的是______ 。
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:
II.已知:
 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色
在溶液中为黄色(1)下列反应曾用于检测司机是否酒后驾驶:2
 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH①基态Cr原子外围电子排布图为
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为
(2)有下列实验:

①呈天蓝色的离子的化学式为
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是
③下列有关化学实验的“操作→现象→解释”均正确的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | Fe3++3SCN-=Fe(SCN)3↓ |
| B | 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知Cr3+的配位数为6,则 CrCl3·6H2O的化学式可表示为[Cr(H2O)5Cl]Cl2·H2O |
| C | 向溶液K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH | 溶液先橙色加深,后变为黄 色 | 溶液中存在 +H2O⇌2 +H2O⇌2 +2H+ +2H+ |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
您最近一年使用:0次
20-21高三上·山东济宁·阶段练习
名校
解题方法
2 . 向H2O2溶液中滴加少量FeSO4溶液,溶液迅速变黄,稍后产生气体;再加入KSCN溶液,溶液变红,一段时间后,溶液颜色明显变浅。依据实验现象,下列分析不正确 的是
| A.产生气体的原因是FeSO4将H2O2还原生成了O2 |
| B.H2O2溶液与FeSO4溶液反应生成Fe3+的证据是“溶液迅速变黄”和“溶液变红” |
| C.溶液颜色变浅,可能是过量的H2O2氧化了KSCN |
| D.溶液变红的原因可用Fe3++3SCN-=Fe(SCN)₃↓表示 |
您最近一年使用:0次
2020-10-14更新
|
354次组卷
|
3卷引用:本册综合检测(A)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)
(已下线)本册综合检测(A)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)山东省新泰市第一中学东校2021-2022学年高三上学期第一次月考化学试题山东省济宁市兖州一中2021届高三10月月考化学试题
解题方法
3 . 铁、铝是重要的金属材料,铁、铝及其化合物有非常重要的用途。
(1)下列说法正确的是____________ (填序号)。
①配制氯化铁溶液,先将FeCl3固体溶于较浓盐酸,再用蒸馏水稀释到所需浓度
②FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③利用氯水和KSCN溶液可以检验Fe3+中有无Fe2+
④加热蒸干Fe2(SO4)3溶液获得Fe2(SO4)3固体
⑤由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾 (K2FeO4)是一种高效多功能水处理剂,其作用原理为___________ 。
(3)以铝土矿(主要成分为Al2O3、Fe2O3和SiO2)为原料制备铝的一种工艺流程如下:

①滤渣主要成分为__________________ 。
②在实验室灼烧操作应选择的主要实验仪器为__________________ 。
③反应Ⅱ中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式:______________________________________________ 。
(4)已知25℃时Ksp[Cu(OH)2]=2.2×10-20 mol3·L-3,Ksp[Fe(OH)3]=4.0×10-38 mol4·L-4,Ksp[Al(OH)3]=1×10-33 mol4·L-4。
①在25℃下,向浓度均为 0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀
0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀______ (填化学式)。
②溶液中某离子物质的量浓度小于等于1.0×10-5mol/L时,可认为该离子已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测得c(Al3+)=0.2mol/L。此时所得沉淀中___________ (填“含有”或“不含”)Al(OH)3。
(1)下列说法正确的是
①配制氯化铁溶液,先将FeCl3固体溶于较浓盐酸,再用蒸馏水稀释到所需浓度
②FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③利用氯水和KSCN溶液可以检验Fe3+中有无Fe2+
④加热蒸干Fe2(SO4)3溶液获得Fe2(SO4)3固体
⑤由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾 (K2FeO4)是一种高效多功能水处理剂,其作用原理为
(3)以铝土矿(主要成分为Al2O3、Fe2O3和SiO2)为原料制备铝的一种工艺流程如下:

①滤渣主要成分为
②在实验室灼烧操作应选择的主要实验仪器为
③反应Ⅱ中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式:
(4)已知25℃时Ksp[Cu(OH)2]=2.2×10-20 mol3·L-3,Ksp[Fe(OH)3]=4.0×10-38 mol4·L-4,Ksp[Al(OH)3]=1×10-33 mol4·L-4。
①在25℃下,向浓度均为
 0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀
0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀②溶液中某离子物质的量浓度小于等于1.0×10-5mol/L时,可认为该离子已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测得c(Al3+)=0.2mol/L。此时所得沉淀中
您最近一年使用:0次
2020-09-14更新
|
1200次组卷
|
3卷引用:选择性必修1 专题3素养检测
19-20高二下·湖北省直辖县级单位·期末
4 . 下列有关化学实验的“操作→现象→解释”均正确的是( )
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | Fe3++3SCN-=Fe(SCN)3↓ |
| B | 向由0.1molCrCl3•6H2O配成的溶液中加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知Cr3+的配位数为6,则CrCl3•6H2O的化学式可表示为[Cr(H2O)6]Cl3 |
| C | 向溶液K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH | 溶液先橙色加深,后又变为黄色 | 溶液中存在Cr2O (橙色)+H2O (橙色)+H2O 2CrO 2CrO (黄色)+2H+ (黄色)+2H+ |
| D | 向Cu(OH)2悬浊液中滴加氨水 | 沉淀溶解 | Cu(OH)2不溶于水,但溶于氨水,重新电离成Cu2+和OH- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-08-25更新
|
241次组卷
|
4卷引用:第2章 微粒间相互作用与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)
(已下线)第2章 微粒间相互作用与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)湖北省仙桃、天门、潜江2019-2020学年高二下学期期末考试化学试题浙江省“南太湖”联盟2021-2022学年高二下学期第一次联考化学试题 福建省南平市浦城县2022-2023学年高二下学期期中考试化学试题
5 . 实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α-Fe2O3。
其主要实验流程如下:

(1)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________ (填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成___________ (填化学式);检验Fe3+是否还原完全的实验操作是______________ 。
(3)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是___________ [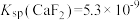 ,
,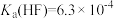 ]。
]。
(4)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为____________ 。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:__ 。
【FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5】。
其主要实验流程如下:

(1)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成
(3)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是
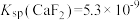 ,
,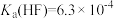 ]。
]。(4)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:
【FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5】。
您最近一年使用:0次
2020-07-11更新
|
7211次组卷
|
18卷引用:选择性必修1 专题3素养检测
选择性必修1 专题3素养检测(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)江苏省海安高级中学2021-2022学年高二上学期阶段测试(二)化学试题2020年江苏卷化学高考试题(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编(已下线)第七单元 水溶液中的离子平衡测试题-2021年高考化学一轮复习名师精讲练(已下线)专题讲座(八) 无机化工流程题的解题策略(精讲)——2021年高考化学一轮复习讲练测山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)2020年江苏卷化学高考真题变式题16-21(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)题型29 以工艺流程为载体考查铁及其化合物之间的转化(已下线)考点10 铁及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)工业流程题



