名校
解题方法
1 . 下列离子方程式中,书写正确的是
A.Na2S2O3溶液中加入稀盐酸:2S2O +2H+=SO +2H+=SO +3S↓+H2O +3S↓+H2O |
| B.氯化铁溶液与适量铜粉混合:Cu+Fe3+=Cu2++Fe2+ |
C.磁性氧化铁溶于足量稀硝酸:3Fe3O4+28H++NO =9Fe3++NO↑+14H2O =9Fe3++NO↑+14H2O |
D.碳酸氢铵溶液与足量NaOH 溶液混合:HCO +OH-=CO +OH-=CO +H2O +H2O |
您最近一年使用:0次
2022-09-10更新
|
286次组卷
|
2卷引用:四川省成都市双流中学2022-2023学年高三上学期9月月考理科综合化学试题
解题方法
2 . 粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
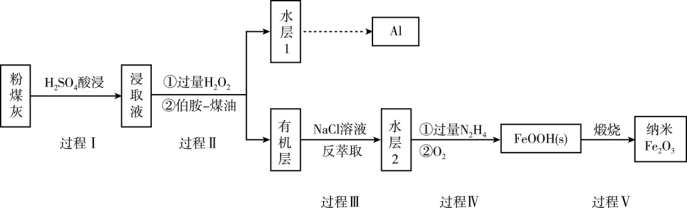
已知:
i)伯胺R-NH2能与Fe3+反应;3R-NH2+Fe3++SO42-+H2O Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl- [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_________ 。
(2)写出过程II加入过量H2O2发生的离子方程式_________ 。加入伯胺-煤油对浸取液进行分离,该操作的名称是_________ 。
(3)从化学平衡角度解释过程III利用NaCl溶液进行反萃取的原理________ 。
(4)过程IV中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+.4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_________ 。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。
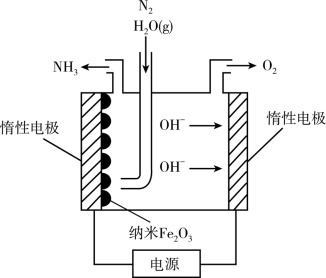
已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:该电解池第二步:2Fe+N2+3H2O=Fe2O3+2NH3。则该电解池第一步发生反应的方程式为_________ 。纳米Fe2O3在电解过程中所起的作用是_______ 。

已知:
i)伯胺R-NH2能与Fe3+反应;3R-NH2+Fe3++SO42-+H2O
 Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-
 [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是
(2)写出过程II加入过量H2O2发生的离子方程式
(3)从化学平衡角度解释过程III利用NaCl溶液进行反萃取的原理
(4)过程IV中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+.4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。

已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:该电解池第二步:2Fe+N2+3H2O=Fe2O3+2NH3。则该电解池第一步发生反应的方程式为
您最近一年使用:0次
2019高三·全国·专题练习
3 . 向Cu、Fe和Fe2O3的混合物中加入稀硫酸发生反应。下列说法正确的是( )
| A.反应后溶液可能显中性 |
| B.反应停止后一定有固体剩余 |
| C.反应过程中一定有氧化还原反应发生 |
| D.若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
您最近一年使用:0次
名校
解题方法
4 . 三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是______________________ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________ 。简述你的理由_____________ .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为_________ ,写出其中发生的氧化还原反应的离子方程式____________________________ 。探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg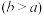 ,则混合物中Cu2O的质量分数为
,则混合物中Cu2O的质量分数为___________ 。
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg
 ,则混合物中Cu2O的质量分数为
,则混合物中Cu2O的质量分数为
您最近一年使用:0次
2016-12-09更新
|
321次组卷
|
3卷引用:2016届四川省宜宾三中高三上学期第一次月考化学试卷1
5 . Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到金属混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生l0.00g白色沉淀,则a 的数值为
| A.4.92 | B.6.42 | C.7.18 | D.14.82 |
您最近一年使用:0次
2016-12-09更新
|
190次组卷
|
3卷引用:2015届四川省成都郫县高三第二次阶诊断性考试理综化学试卷



