名校
解题方法
1 . 铁是人类使用最早的金属之一。运用所学知识,回答下列问题:
(1)电子工业用FeCl3,溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的化学方程式为______ 。
(2)某研究性学习小组为测定FeCl3溶液腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子有______ 。
②验证该溶液中是否含有Fe2+,正确的实验方法是______ (填序号)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液先滴入双氧水再滴入KSCN溶液,若溶液显红色,证明原溶液中含有Fe2+
D.取适量溶液,滴入K3[Fe(CN)6]溶液,若产生蓝色沉淀,证明含有Fe2+
(3)工程师欲从制造印刷电路板的废液中回收铜,并获得FeCl3,溶液,设计如下方案:______ 。
②向滤液B和滤液E中通入F的目的是______ ,该反应的离子方程式为______ 。
③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是______ (填序号)。
A.有铜单质剩余但无铁单质剩余 B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余 D.铁、铜单质都无剩余
(1)电子工业用FeCl3,溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的化学方程式为
(2)某研究性学习小组为测定FeCl3溶液腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子有
②验证该溶液中是否含有Fe2+,正确的实验方法是
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液先滴入双氧水再滴入KSCN溶液,若溶液显红色,证明原溶液中含有Fe2+
D.取适量溶液,滴入K3[Fe(CN)6]溶液,若产生蓝色沉淀,证明含有Fe2+
(3)工程师欲从制造印刷电路板的废液中回收铜,并获得FeCl3,溶液,设计如下方案:
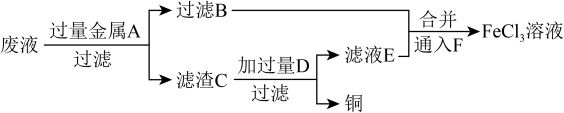
②向滤液B和滤液E中通入F的目的是
③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.有铜单质剩余但无铁单质剩余 B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余 D.铁、铜单质都无剩余
您最近一年使用:0次
2022高三·全国·专题练习
2 . 黄钠铁矾[NaFe3 (SO4)2(OH)6]是一种高效净水剂,Ni(OH)2可作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备黄钠铁矾和Ni (OH)2,工艺流程如图所示。
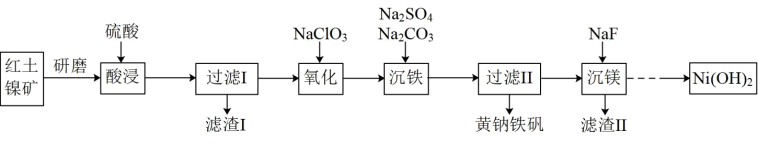
已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
“氧化”过程中发生反应的离子方程式为:_______ ;为 了证明加入的NaClO3已足量,可取“氧化”后的溶液,向其中加入_______ 来检验(填标号)。
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 c.酸性KMnO4溶液

已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
“氧化”过程中发生反应的离子方程式为:
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 c.酸性KMnO4溶液
您最近一年使用:0次
解题方法
3 . 铁是目前用途最广、用量最大的金属。请回答下列问题。
(1)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是_______ ;分离提纯混有NaCl的Fe(OH)3胶体的方法是_______ 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的成分为_______ ;
②试剂F宜选用_______ (填选项序号)
A.酸性KMnO4溶液 B.氯水 C.溴水
③往FeCl3腐蚀铜后所得溶液中滴入KSCN溶液呈红色,证明该溶液中含有的金属阳离子是_______ ;
(1)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的成分为
②试剂F宜选用
A.酸性KMnO4溶液 B.氯水 C.溴水
③往FeCl3腐蚀铜后所得溶液中滴入KSCN溶液呈红色,证明该溶液中含有的金属阳离子是
您最近一年使用:0次
2022高三·全国·专题练习
4 . 镍、钴及其化合物在工业上有广泛的应用。以含镍废料(主要成分为NiO,含少量FeO、Fe2O3、CoO、BaO和SiO2)为原料制备NixOy和碳酸钴(CoCO3)的工艺流程如图。

已知: Ksp[Co(OH)2]=2 ×10-15, 请回答以下问题:
“氧化” 时反应的离子方程式是_______ ,为证明添加NaClO3已足量,可用_______ (写化学式)溶液进行检验。

已知: Ksp[Co(OH)2]=2 ×10-15, 请回答以下问题:
“氧化” 时反应的离子方程式是
您最近一年使用:0次
5 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是____ (填字母代号)。
(2)向沸水中逐滴滴加lmol/LFeCl3溶液,至____ ,该分散系中粒子直径的范围是____ nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:____ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:首先取少量待测溶液﹐滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是____ ,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,____ (填实验操作,下同)、洗涤、干燥,称量沉淀质量为43.05g。则待测溶液中,FeCl3的物质的量浓度为____ 。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是____ (填字母代号)。
A.向试管中加入试液,滴入KSCN溶液,若显红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液,设计实验方案如图:

A.请写出上述实验中加入或生成的有关物质的化学式:①____ ;②____ ;③____ ;④____ 。
B.请写出通入⑥的化学方程式:_____ 。
(1)所含铁元素既有氧化性又有还原性的物质是
| A.Fe | B.FeCl2 | C.FeSO4 | D.Fe2O3 |
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(4)若要验证该溶液中含有Fe2+,正确的实验方法是
A.向试管中加入试液,滴入KSCN溶液,若显红色,证明含有Fe2+
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液,设计实验方案如图:

A.请写出上述实验中加入或生成的有关物质的化学式:①
B.请写出通入⑥的化学方程式:
您最近一年使用:0次
名校
解题方法
6 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。工业上用废铁生产FeSO4·7H2O的一种流程如图所示:
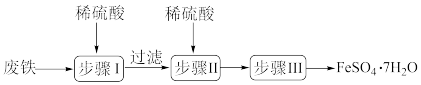
(1)步骤I中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:_______ 。
(2)证明步骤I滤液中只含有Fe2+的方法:取样,先滴加_______ ,再滴加_______ (填试剂名称),该过程的现象为_______ 。
(3)步骤III从硫酸亚铁溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的实验操作为蒸发浓缩、冷却结晶、_______ 、冰水洗涤、烘干。烘干操作需在低温条件下进行,原因是_______ 。
(4)取27.8gFeSO4·7H2O隔绝空气加热至不同温度,剩余固体的质量变化如下图所示。
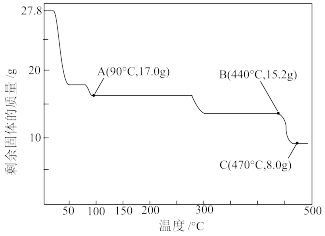
分析数据,写出90°C残留物的化学式_______ ;440°C~470°C时固体物质发生反应的化学方程式是_______ 。

(1)步骤I中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:
(2)证明步骤I滤液中只含有Fe2+的方法:取样,先滴加
(3)步骤III从硫酸亚铁溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的实验操作为蒸发浓缩、冷却结晶、
(4)取27.8gFeSO4·7H2O隔绝空气加热至不同温度,剩余固体的质量变化如下图所示。

分析数据,写出90°C残留物的化学式
您最近一年使用:0次
2022-07-13更新
|
306次组卷
|
2卷引用:上海市川沙中学2021-2022学年高一下学期期末考试化学试题
名校
7 . 电子工业常用30%的 溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
(1)写出 溶液与金属铜反应的离子方程式:
溶液与金属铜反应的离子方程式:___________ 。
(2)检验溶液中存在 的试剂是
的试剂是___________ ,证明 存在的现象是
存在的现象是___________ 。
(3)某小组采取下列步骤从使用过的腐蚀废液中回收钢,并重新获得 溶液:
溶液:

操作Ⅰ和Ⅱ使用到的主要玻璃仪器有___________ ,请写出通入⑥后发生反应的离子方程式:___________ 。
(4)实验室里保存 溶液时,常在溶液中加入铁钉或铁粉防止溶液里的
溶液时,常在溶液中加入铁钉或铁粉防止溶液里的 被氧化,请用离子方程式说明其中的道理:
被氧化,请用离子方程式说明其中的道理:___________ 。
(5)若某腐蚀液中含 、
、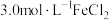 、
、 ,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为
,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为___________ 。
 溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。(1)写出
 溶液与金属铜反应的离子方程式:
溶液与金属铜反应的离子方程式:(2)检验溶液中存在
 的试剂是
的试剂是 存在的现象是
存在的现象是(3)某小组采取下列步骤从使用过的腐蚀废液中回收钢,并重新获得
 溶液:
溶液:
操作Ⅰ和Ⅱ使用到的主要玻璃仪器有
(4)实验室里保存
 溶液时,常在溶液中加入铁钉或铁粉防止溶液里的
溶液时,常在溶液中加入铁钉或铁粉防止溶液里的 被氧化,请用离子方程式说明其中的道理:
被氧化,请用离子方程式说明其中的道理:(5)若某腐蚀液中含
 、
、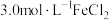 、
、 ,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为
,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为
您最近一年使用:0次
解题方法
8 . 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是___ ,证明Fe3+存在的现象是___ 。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式___ 。
(3)某工程师为了从使用过的腐蚀废液(主要含Fe3+、Fe2+、Cu2+、Cl-)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
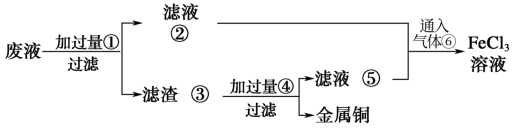
请写出上述实验中加入或生成的有关物质的化学式。
①___ ,④___ 。
(4))写出向②⑤的混合液中通入⑥的离子方程式:___ 。
(5)将铜片放入0.1mol/LFeCl3溶液中,反应一段时间后取出铜片,溶液中c(Fe3+):c(Fe2+)=2:3,则此时溶液中的Cu2+与Fe3+的物质的量之比为___ 。
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式
(3)某工程师为了从使用过的腐蚀废液(主要含Fe3+、Fe2+、Cu2+、Cl-)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①
(4))写出向②⑤的混合液中通入⑥的离子方程式:
(5)将铜片放入0.1mol/LFeCl3溶液中,反应一段时间后取出铜片,溶液中c(Fe3+):c(Fe2+)=2:3,则此时溶液中的Cu2+与Fe3+的物质的量之比为
您最近一年使用:0次
名校
解题方法
9 . 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________ ,证明Fe3+存在的现象是________ 。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________ 。
(3)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________ 。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(4)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式④____________ 。
(5)写出向⑤的混合液中通入⑥的离子方程式:______________________ 。
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:
(3)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(4)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式④
(5)写出向⑤的混合液中通入⑥的离子方程式:
您最近一年使用:0次
解题方法
10 . 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___ ,证明Fe3+存在的现象是____ ,配制含Fe2+的溶液时,常常向溶液中加入少量___ ,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___ 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
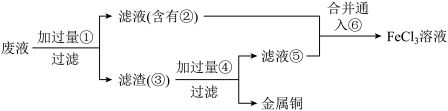
A.请写出上述实验中加入或生成的有关物质的化学式。
①___ ,②___ ,③___ ,④____ ,⑤____ ,⑥_____ 。
B.请写出相关反应的化学方程式。_______ 。
(1)检验溶液中Fe3+存在的常用试剂是
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

A.请写出上述实验中加入或生成的有关物质的化学式。
①
B.请写出相关反应的化学方程式。
您最近一年使用:0次
2020-01-07更新
|
268次组卷
|
4卷引用:云南省临沧市耿马县民族中学2019-2020学年高一上学期12月月考化学试题
云南省临沧市耿马县民族中学2019-2020学年高一上学期12月月考化学试题贵州省黎平第二中学2019-2020学年高一上学期期末考试化学试题广西壮族自治区崇左市天等县民族高中2019-2020学年高一上学期期末考试化学试题(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)



