名校
解题方法
1 . 部分含铁的纯净物的“价-类”关系如图所示。下列叙述错误的是
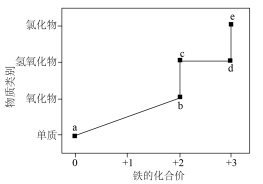
| A.图中相邻物质中c→d在空气里最易转化 | B.在隔绝空气条件下加热 可得到b 可得到b |
C.在高温下a与水蒸气反应生成b和 | D.e溶液中加入铜粉,发生氧化还原反应 |
您最近一年使用:0次
2024-05-18更新
|
151次组卷
|
2卷引用:河北省保定市2024届高三下学期二模化学试题
2 . 利用下图装置可制备 沉淀,且能较长时间保存该物质而不变质。下列说法不正确的是
沉淀,且能较长时间保存该物质而不变质。下列说法不正确的是
 沉淀,且能较长时间保存该物质而不变质。下列说法不正确的是
沉淀,且能较长时间保存该物质而不变质。下列说法不正确的是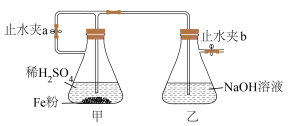
| A.实验开始时,打开止水夹a和止水夹b |
| B.关闭止水夹a,打开止水夹b,甲中溶液可流入乙中 |
C. 能较长时间保存是因 能较长时间保存是因 无氧化性 无氧化性 |
| D.抽滤瓶甲中的稀硫酸可以用稀硝酸代替 |
您最近一年使用:0次
2024高三·全国·专题练习
3 . 下列反应方程式书写错误的是
| A.硫酸亚铁溶液与过氧过氢溶液反应:2Fe2++H2O2+2H+=2Fe3++2H2O |
| B.向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Cl-+2Fe3+ |
| C.硫氰化钾检验溶液中是否存在Fe3+:Fe3++3SCN-=Fe(SCN)3 |
| D.制备氢氧化亚铁时,白色沉淀会快速变为灰绿色最后变为红褐色的原因:4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
您最近一年使用:0次
4 . Fe(OH)2具有较强的还原性,新制的白色Fe(OH)2会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色Fe(OH)2,某实验小组做了如下探究实验。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、___________ 、___________ 。
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是___________ 。
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:___________ 。___________ (用离子方程式表示)。
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:___________ 。
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
①由以上实验可得到的规律是___________ 。
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为___________ (填“1.0”“1.5”或“2.0”)mol/L。
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为___________ (任写一条)。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:

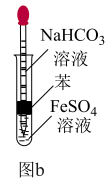
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
c(NaHCO3)/(mol/L) c(FeSO4)/(mol/L) | 1.0 | 1.5 | 2.0 | |
| 1.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 3.5 min | 9 min | 24 min | |
| 1.5 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 13 min | 15 min | 22 min | |
| 2.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率加快 | 常温下无现象,加热后产生白色沉淀 |
| 稳定时间 | 3 min | 8 min | 30 min | |
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为
您最近一年使用:0次
2024-04-16更新
|
304次组卷
|
2卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
5 . 部分含Fe物质的分类与相应化合价关系如图所示。下列推断不合理的是


| A.可存在f→d→e的转化 |
B.高温下a与 反应制备c 反应制备c |
| C.KSCN溶液可用于鉴别f和g |
| D.a在g溶液中反应生成f |
您最近一年使用:0次
解题方法
6 . 硫酸亚铁铵是一种重要的化工原料,用途广泛,其晶体为浅绿色,俗名摩尔盐,化学式为 。某小组设计如下实验进行探究:
。某小组设计如下实验进行探究:
I.制备
(1)向新制的
 溶液中加入一定质量的
溶液中加入一定质量的 固体,在
固体,在 条件下溶解后,趁热倒入50mL乙醇中,析出晶体。实验时所采用的加热方式是
条件下溶解后,趁热倒入50mL乙醇中,析出晶体。实验时所采用的加热方式是Ⅱ.i.测定 含量(蒸馏法,装置如图)
含量(蒸馏法,装置如图)

①称取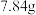 晶体加水溶解后,将溶液注入三颈烧瓶中;
晶体加水溶解后,将溶液注入三颈烧瓶中;
②准确量取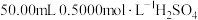 溶液于锥形瓶中;
溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶,用蒸馏水冲洗冷凝管内通道2~3次,将洗涤液注入锥形瓶中;
④用 的NaOH标准溶液滴定锥形瓶中过量的硫酸,以酚酞为指示剂,滴定终点时消耗
的NaOH标准溶液滴定锥形瓶中过量的硫酸,以酚酞为指示剂,滴定终点时消耗 NaOH标准溶液。
NaOH标准溶液。
(2)步骤②中,量取
 溶液的仪器是下图所示仪器中的
溶液的仪器是下图所示仪器中的
(3)步骤③中,三颈烧瓶中可能发生的氧化还原反应的化学方程式是
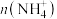 的值将
的值将(4)步骤④中达到滴定终点的现象是
ii.测定 含量(重量分析法)
含量(重量分析法)
⑤另取一份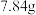 晶体于烧杯,加水溶解,边搅拌边加入过量的
晶体于烧杯,加水溶解,边搅拌边加入过量的 溶液;
溶液;
⑥抽滤,用稀硫酸洗涤沉淀3次;将所得沉淀充分干燥,称量,得沉淀质量为 。
。
(5)步骤⑤中,判断
 溶液已过量的实验操作和现象是
溶液已过量的实验操作和现象是(6)结合实验I和Ⅱ,通过计算得出该晶体的化学式为
您最近一年使用:0次
解题方法
7 . 下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是


| A.②③④⑤ | B.①②④⑤ | C.①③④⑤ | D.①②③⑤ |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
8 . 化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价—类”二维图。铁元素的“价—类”二维图如图所示,下列说法正确的是___________ 。
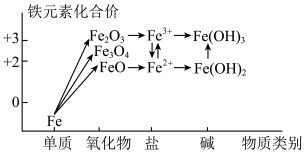
A.工业上用CO还原 炼铁,该反应为置换反应
炼铁,该反应为置换反应
B. 中铁元素为+4价
中铁元素为+4价
C.维生素C能将 转化为
转化为 ,该过程中维生素C作还原剂
,该过程中维生素C作还原剂
D. 浊液露置于空气中,由白色立即变为红褐色
浊液露置于空气中,由白色立即变为红褐色
E.FeO与稀硝酸反应生成Fe(NO3)2
F.Fe在氧气中燃烧,生成Fe3O4
G.FeCl2溶液可用KSCN溶液检验

A.工业上用CO还原
 炼铁,该反应为置换反应
炼铁,该反应为置换反应B.
 中铁元素为+4价
中铁元素为+4价C.维生素C能将
 转化为
转化为 ,该过程中维生素C作还原剂
,该过程中维生素C作还原剂D.
 浊液露置于空气中,由白色立即变为红褐色
浊液露置于空气中,由白色立即变为红褐色E.FeO与稀硝酸反应生成Fe(NO3)2
F.Fe在氧气中燃烧,生成Fe3O4
G.FeCl2溶液可用KSCN溶液检验
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
9 . 在两支试管里分别加入少量的FeCl3溶液和新制FeSO4溶液,然后各滴入NaOH溶液,观察并记录现象。

(1)FeCl3溶液呈_______ 色,向FeCl3溶液中滴加NaOH溶液,现象为_______ ,反应的离子方程式为_______ 。
(2)FeSO4溶液呈_______ 色,向FeSO4溶液中滴加NaOH溶液,立即_______ ,离子方程式为_______________ ,然后生成的白色絮状沉淀迅速变成_______ 色,过一段时间后,最终变成了___________ 。变成红褐色的原因是_______ ,化学方程式为_______ 。
(3)将甲、乙两试管中的固体分别取出放入烧杯中,分别加入足量的稀盐酸,观察到的现象均为固体_______ ,烧杯中得到_________ 色溶液,离子方程式为_______ 。
(4)白色的Fe(OH)2会被溶解在溶液中的O2氧化,那么在实验室里制取纯净氢氧化亚铁前应该:_____________ 。

(1)FeCl3溶液呈
(2)FeSO4溶液呈
(3)将甲、乙两试管中的固体分别取出放入烧杯中,分别加入足量的稀盐酸,观察到的现象均为固体
(4)白色的Fe(OH)2会被溶解在溶液中的O2氧化,那么在实验室里制取纯净氢氧化亚铁前应该:
您最近一年使用:0次
10 . 部分氯、铁及其化合物的“价一类”关系如图所示。下列叙述正确的是
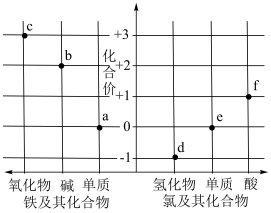

| A.b、c分别与足量氢碘酸反应都会生成FeI2 |
| B.等质量的a分别与足量d、e完全反应,转移电子数相等 |
| C.b、f久置于空气中均不会发生化学反应 |
| D.b在空气中灼烧不能生成c |
您最近一年使用:0次
2024-02-02更新
|
164次组卷
|
2卷引用:江西省部分学校2023-2024学年高三上学期12月月考化学试题



